摘 要: 目的:分析恩替卡韦致不良反应(ADR)发生情况及临床特点,为合理用药提供参考。方法:检索2005年4月~2019年8月CNKI、WanFang Data、VIP及PubMed数据库,对收集到的恩替卡韦致ADR文献报道按照患者性别、年龄、国籍、原患疾病、用药剂量、合并用药,ADR出现时间、类型、累及器官/系统、临床表现、处理及转归等情况进行统计分析。结果:共纳入文献41篇,涉及恩替卡韦所致ADR病例46例。患者年龄主要集中在41~60岁(29例,63.04%);男性35例(76.09%),女性11例(23.91%);用药剂量多为0.5 mg·d-1;用药1个月内出现ADR的例数最多(24例,52.17%);患者主要来源于东亚国家和地区(37例,80.43%);恩替卡韦所致ADR以中枢及外周神经系统最多,其次为肌肉骨骼系统和皮肤及其附件;新的严重的ADR为视力减退和高脂血症性胰腺炎;ADR关联性评价:很可能35例,可能9例,肯定2例。结论:临床应重视恩替卡韦所致ADR,尤其应关注易发生ADR的高风险人群,早期发现,对症治疗,确保患者用药安全。
关键词: 恩替卡韦; 药品不良反应; 文献综述;
Abstract: Objective:To analyze the general patterns and characteristics of adverse drug reactions induced by entecavir,and provide reference for clinical medication. Methods:CNKI, WanFang Data, VIP and PubMed databases were searched for ADRs induced by entecavir from April 2005 to August 2019. The literatures on 46 cases of entecavir induced ADRs were reported and statistically analyzed on the gender, age, nationality, original disease, using dose, combined medication, adverse reaction time, clinical types of adverse reactions, involved organs or systems, clinical treatment and outcome of the patients. Results:A total of 41 articles were included in the literature, involving 46 cases of adverse reactions caused by taking entecavir. The age of the patients is mainly from 41 to 60 years old(29 cases, 63.04%). 35 cases for males(76.09%) and 11 cases for females(23.91%). The most dosage was 0.5 mg·d-1. Most cases of ADR appeared in the first month after taking the medication(24 cases, 52.17%). The patients are mainly from countries or regions in East Asia(37 cases, 80.43%). The organ/system that most frequently effected by the adverse reactions caused by taking entecavir was the central and peripheral nervous system. The second most frequently affected one is the musculoskeletal system and skin and its accessorie. The new serious ADRs were visual impairment and hyperlipidemic pancreatitis. 35 cases were probable type, 9 cases were possible type and 2 cases were affirmative type by causality assessment of adverse reactions to drugs. Conclusion:Clinical attention should be paid to the adverse reactions caused by entecavir, especially on the high-risk group who are easier to have those adverse reactions. Early diagnosis and timely treatment will ensure patients with drugs safety.
Keyword: Entecavir; Adverse drug reactions; Literature analysis;
恩替卡韦(entecavir,ETV)为新一代核苷(酸)类似物(nucleoside analogues,NAs)类口服抗病毒药物,2005年4月8日经美国食品药品管理局(FDA) 批准在美国上市,因其抗病毒作用强、耐药率低、不良反应(adverse drug reaction,ADR)小而成为慢性乙型肝炎(chronic hepatitis B,CHB)长期治疗的一线药物之一[1,2,3]。ETV说明书记载的常见ADR主要有头痛、疲劳、眩晕、恶心等,多数轻微可耐受。随着ETV临床使用逐渐广泛,其相关的新的、严重的ADR也引起临床的重视。本文检索国内外有关恩替卡韦ADR的文献报道并加以整理分析,以期为该药的临床安全使用提供参考。

1 、资料与方法
1.1、 资料来源
计算机检索CNKI、WanFang Data、VIP和PubMed数据库,检索时段为2005 年4月~2019年8月,中文以“恩替卡韦”及“致”或“不良反应”“病例”为检索词,英文以“entecavir”及 “induced”或“adverse reaction”“case”为检索词,收集国内外公开发表的ETV导致的ADR文献报道。
1.2、 文献纳入排除标准
1.2.1、 纳入标准
国内外公开发表的有关恩替卡韦ADR的临床研究与病例报道类文献,患者均有乙肝病史,病例资料完整,ADR均发生在使用ETV后;按诺氏(Naranjo)评估量表中的关联性评价标准[4],对文献报道中ETV与ADR进行关联性评价,纳入结果为肯定相关、很可能相关、可能相关的病例。
1.2.2、 排除标准
病例资料描述不详尽及重复报道的病例;综述、科普、摘要类文献;ADR关联性评价结果为不可能的病例。
1.3 、统计分析方法
1.3.1、 研究项目
对文献病例中的患者性别、年龄、国籍、原患疾病、用药剂量、联合用药,以及ADR出现时间、类型、累及器官/系统、临床表现、处理、及转归等进行统计分析。ADR类型按《药品不良反应报告和监测工作手册》中“新的”和“严重的”ADR的定义[5]确定。
1.3.2 、数据处理方法
录入Excel表格中,建立Excel数据库,然后对数据信息进行统计分析。
2、 结果
2.1 、文献检索流程与结果
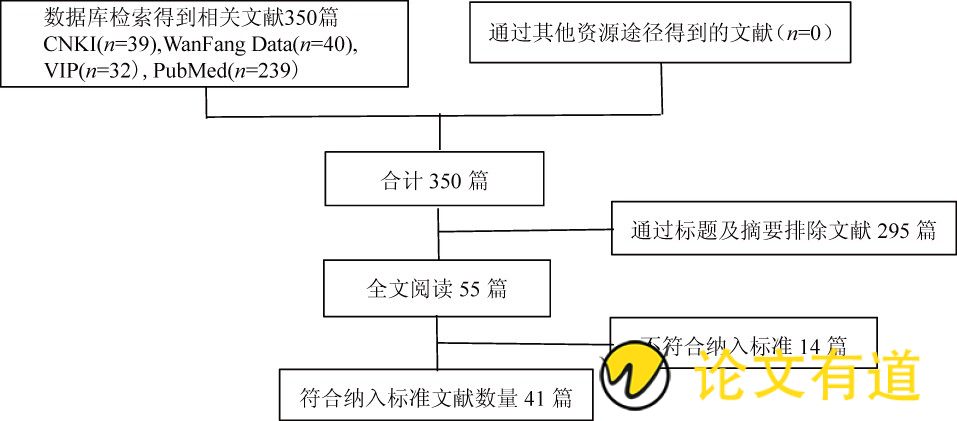
文献检索得到相关文献350篇,按“1.2”项下标准筛选出ETV相关ADR的文献报道41篇,其中中文文献22 篇,英文文献18篇,韩语文献1篇,涉及ETV的ADR病例共46例。文献筛选流程见图1。
图1 文献筛选流程图
2.2、 ADR病例一般情况
2.2.1、 病例的性别与年龄分布
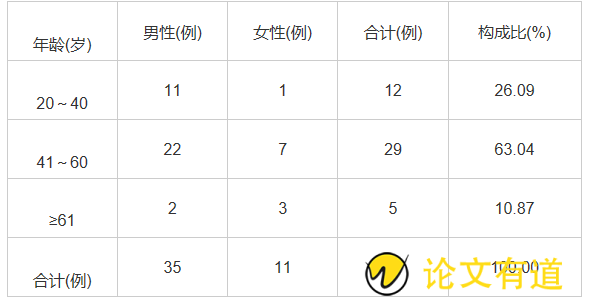
46例ADR患者中,男35例(76.09%),女11例(23.91%);年龄最小21岁,最大76岁,平均年龄为47.43岁。患者年龄性别分布见表1。
表1 ETV相关ADR患者性别与年龄分布
2.2.2 、ADR报告来源地
46例病例分别来源于10个国家,其中中国29例(63.04%),土耳其5例(10.87%),韩国和日本各3例(6.52%),克罗地亚、美国、中国台湾地区、意大利、英国和越南各1例(2.17%),病例来源以东亚国家和地区(37例,80.43%)为主。
2.2.3、 ADR病例原患疾病
46例患者均有乙肝病史,其中慢性乙型肝炎28例(60.87%),肝硬化14 例(30.43%),肝癌3 例(6.52%),急性重型肝炎1例(2.17%)。
2.3 、ETV相关ADR病例的用法用量与合并用药情况
所有患者使用ETV均为po,qd给药,具体剂量分布:0.5 mg 43例,1.0 mg 2例,另有1例0.5 mg使用14 d,继续1.0 mg使用14 d。上述剂量均在说明书推荐用量范围内。
46例ADR病例中,42例仅服用ETV单药,4例存在合并用药,分别为ETV联合槐耳颗粒致严重腹泻[6];ETV联合匹伐他丁致横纹肌溶解[7];ETV联合氯吡格雷致血小板减少[8];ETV联合利奈唑胺致乳酸性酸中毒[9]。
2.4 、ADR 发生时间
46例ADR病例中,发生ADR时间最短的是用药1 h后出现严重腹泻,时间最长的为用药5年后出现肌痛,其中用药1个月内ADR病例数最多,为24例(52.17%),其他依次为1~3个月8例(17.39%),4~6月和7~12个月各4例(8.70%),超过12个月6例(13.04%)。
2.5、 ADR累及器官/系统和临床表现
ETV相关ADR累及器官/系统以中枢及外周神经系统最多,为10例次(21.73%)、其次为肌肉骨骼系统和皮肤及其附件,均为8 例次(17.39%)。所有患者出现的ADR均累及单一的器官或系统。具体分布见表2。
表2 ETV相关ADR累及器官/系统及临床表现

2.6、 新的、严重的ADR发生情况
46例ADR中新的ADR共16例(34.78%),分别为周围神经病8例,慢性炎症性脱髓鞘性多发神经病2例,抑郁加重1例,干眼症1例,性欲减退2例,男性乳房发育1例,甲状腺功能亢进1例;严重的ADR共10例(21.74%),分别为横纹肌溶解4例,中毒性表皮坏死松解症1例,乳酸性酸中毒4例,严重腹泻1例;有3例分别因视力减退导致永久性器官功能损伤、高脂血症性胰腺炎导致住院,为新的严重的ADR,具体临床表现见表2。
2.7、 ADR的 处理与转归
46例患者均给予对症处理,其中43例停用ETV,治愈38例,未好转1例,失访1例,死亡3例;2例减量使用ETV,均好转;1例患者未停用ETV,ADR未继续进展。
2.8、 关联性评价
采用诺氏(Naranjo)评估量表[4]进行关联性评价,结果46例病例中,很可能有关35例(76.09%);可能有关9例(19.57%);判定为肯定有关2例(1例肌痛和1例斑丘疹患者停药后症状消失,重复给药后症状再次出现,再次停药后症状又消失)。
3、 讨论
3.1、 年龄、性别及国籍分布
从统计结果来看,发生ADR的患者年龄主要集中在41~60 岁( 29 例,63.04% ),患者男女比例为3.18∶1,有明显性别差异,可能与ETV的使用人群有关,文献报道CHB主要集中在青年人(18~40岁)和中年人(41~65岁),且在男性中发生率高(72.89%)[10],这导致ETV在此类人群使用机会增加,ADR增多。本次报道的46例患者,大部分来自东亚地区,可能是因为HBsAg在东亚地区阳性率较高(8.6%)[11],而ETV致ADR是否与种族有关,还需要进一步研究。
3.2、 ADR发生时间
ETV使用后1个月内ADR病例数最多(24例,52.17%),累及器官/系统广泛,其中肌肉骨骼系统、皮肤及其附件ADR最常见,其次为中枢及外周神经系统、血液系统的ADR。建议在开始用药1月内密切监测患者服药后反应,加强用药监护。
3.3 、ADR累及器官/系统及临床表现
ADR累及器官/系统以中枢及外周神经系统最多、其次为肌肉骨骼系统和皮肤及其附件。中枢及外周神经系统ADR中又以ETV致周围神经损害最常见,主要临床表现周围神经病、慢性炎症性脱髓鞘性多发神经病。其主要机制可能是NAs对线粒体DNA聚合酶的抑制可导致线粒体内DNA水平的耗竭,从而引起线粒体毒性,导致周围神经损害[12]。也有部分学者认为NAs周围神经损害与左旋肉碱减少有关,左旋肉碱能调节能量代谢和周围神经的功能,并促进神经元损伤后的再生[13],并且在一种核苷类似物Besifovir(贝西福韦)的多中心Ⅱb期研究中观察到左旋肉碱呈剂量依赖性降低[14],ETV导致的周围神经损害是否也与此有关,还有待进一步的研究。本文中10例发生周围神经损害的患者有肝癌1例、肝硬化8例。终末期肝病患者,肝脏解毒能力降低,三大营养物质及微量元素和维生素等多种物质代谢异常,能量摄入不足[15,16],可能是周围神经病变的易感因素[17]。10例患者经停药对症治疗后,均完全恢复,其中有6例患者[17,18]周围神经损害恢复时间与症状出现到停药时间正相关,提示应定期对患者进行随访,如果出现四肢乏力、麻木,要警惕发生周围神经病变,及时停药并对症处理,有助于缩短周围神经病变恢复时间。
个案报道中肌肉毒性也比较常见,与Manns等[12]报道ETV导致的NAs相关ADR常见为肌痛(5%)一致。ETV相关性肌病可能与NAs导致的线粒体毒性有关,当病毒DNA聚合酶被抑制的同时人线粒体DNA聚合酶也可能被抑制,进一步影响氧化磷酸化和ATP产生,导致细胞内ATP耗竭[19],ATP耗竭会引起肌细胞破坏,肌纤维坏死[20],临床上呈现肌病表现。8例肌肉毒性中,4例临床表现为横纹肌溶解,另外4例为肌痛。横纹肌溶解是一种严重的ADR,死亡率高达8%[21],肌酸激酶(CK)是诊断横纹肌溶解及衡量其严重程度的最可靠的生化指标[22],文中4例横纹肌溶解患者的CK值(10 501~20 701U·L-1)明显高于4例肌痛患者的CK值(1 402~6 281 U·L-1),可见监测CK值是预防横纹肌溶解的一个有效措施。值得注意的是有1例横纹肌溶解为ETV和匹伐他汀联合用药导致[7],有报道核苷类抗病毒药物与他汀类药物联用会增加横纹肌溶解风险[23],需引起医务人员重视。还有1例病例在ETV剂量0.5 mg时未出现横纹肌溶解,剂量增加至1.0 mg时出现,减量至0.5 mg,对症治疗后恢复,有报道称替比夫定肌病风险与剂量相关[24],这是不是NAs类药物通性,还有待进一步研究。
本研究收集的ETV引起的皮肤及其附件损害多发生在用药7 d后,有3例患者淋巴细胞刺激试验阳性(其余未检测),已证实药物诱导T细胞活化、增殖可导致药疹[25],提示药疹可能为T细胞介导的迟发性超敏反应。也有研究认为调节性T细胞(regulatory T cells,Tregs)数量变化和功能缺陷是药疹发生的关键因素之一[26]。在接受ETV治疗的患者中,Tregs数量至第6个月时从基线水平逐渐降至最低,且Tregs与Th17 细胞的比值在第3个月最低,并呈现出反向“V”型变化[27],推测药疹发生可能也与Tregs减少有关。更值得关注的是,ETV已被广泛使用,但全部8例患者例均来自亚洲,因为HLA 等位基因与药疹之间的关系已引起人们的极大的关注 [28],所以我们推测遗传差异可能是导致ETV迟发性超敏反应重要因素,但还需要进一步研究证实。
本文报道了5例ETV导致的血小板减少,4例发生时间在ETV使用7 d内,另外1例早期未行血常规检查,与武东等[29]报道的药源性血小板减少症(drug induced thrombocytopenia, DITP)发生时间基本一致。DITP可以是非免疫性的或免疫介导的,非免疫性常继发于药物引起的骨髓抑制[30],这5例血小板减少中1例无骨髓检查,其余4例骨髓检查均正常,提示ETV致DITP可能不是非免疫性DITP。ETV能增强细胞因子释放和免疫介导反应[31],因此猜测ETV致血小板减少可能为免疫介导的DITP,ETV诱导的自身抗体与血小板表面上受体结合,引起免疫反应破坏血小板导致其数目下降[32]。血小板减少病例中有1例为氯吡格雷与ETV联合用药[8],有文献报道2种致DITP药物联用会加重血小板减少,且药物联用是导致血小板减少患者出血的独立危险因素[29],因此,尽量避免ETV与能致DITP的药物联合使用,如必须联合使用时,一般前3个月每2周检查一次血小板计数,以后每2个月检查一次。
本文纳入的4例乳酸性酸中毒患者中有3例死亡,乳酸性酸中毒是ETV最严重的ADR,不及时发现和处理,病死率高达50%以上[33]。ETV致乳酸性酸中毒的机制可能是其在体内抑制线粒体DNA聚合酶,导致线粒体DNA水平降低,氧化磷酸化受阻,无氧酵解取代了有氧代谢,乳酸产生增加[34]。Lange等[35]报道16例ETV治疗的CHB合并肝硬化患者,其中5例出现乳酸性酸中毒,所有发生乳酸性酸中毒的患者终末期肝病模型(Model for end-stage liver disease,MELD)评分均≥20分,文献认为MELD评分≥20分是发生乳酸性酸中毒的必要条件。而本文报道的患者中1例为单纯CHB,另一例肝硬化患者MELD评分=16,其余两例未评价,因此能否将MELD评分≥20分作为乳酸酸中毒发生的预测因子,还需要大规模临床试验来进一步明确。但确有研究证实慢性重症肝炎患者随着MELD评分的增加,血乳酸浓度逐渐增加[36],因此,对于终末期肝病且有严重肝功能损伤的患者,使用ETV要权衡利弊,并常规监测乳酸水平,警惕致死性乳酸性酸中毒发生。且4例乳酸性酸中毒患者中3例并发感染,出现白细胞增高(WBC 4.15×109·L-1,10.2×109·L-1,12.3×109·L-1),与Lange等[35]报道相似,感染能导致血乳酸水平升高[37,38],因此感染可能也是引起患者出现乳酸性酸中毒的一个原因。还有1例患者为利奈唑胺与ETV联合用药引起乳酸性酸中毒[9],利奈唑胺能抑制线粒体蛋白质合成,从而导致线粒体毒性[39],两种均能导致线粒体毒性的药物联用,乳酸性酸中毒发生率可能增加,需引起医务人员警惕。
3.4、 新的、严重的ADR
将文献检索发现的46例ADR与ETV说明书中记载的ADR对比,周围神经病、慢性炎症性脱髓鞘性多发神经病、抑郁加重、视力减退、干眼症、性欲减退例、男性乳房发育、高脂血性胰腺炎、甲状腺功能亢进均为说明书未提及的新的ADR,其中视力减退导致永久性器官功能损伤,高脂血症性胰腺炎导致住院,为新的严重的ADR,虽然这些ADRs比较罕见,但需引起医务人员重视。另外,建议药品生产企业主动跟踪药品上市后的安全性情况,必要时根据本研究结果开展IV期临床研究,依据药品再评价及ADR监测结果,及时申请对说明书做出修改,保障患者用药安全。
3.5 、小结
综上所述,ETV作为慢性乙型肝炎长期治疗的一线用药,使用越来越广泛,新的严重的ADR逐渐出现,这就需要临床医生、药师加强ADR的监测,特别要关注终末期肝病患者,其更易发生周围神经损害和致死性乳酸性酸中毒,能够及时发现并处理这些ADR更有利于保证患者用药安全。
参考文献
[1]Lam Y,Seto W,Wong D,et al.Seven-Year Treatment Outcome of Entecavir in a Real-World Cohort:Effects on Clinical Parameters,HBsAg and HBcrAg Levels[J].Clin Transl Gastroenterol,2017,8(10):e125
[2] 李晨,黄朝丰,刘青,等.恩替卡韦治疗慢性乙型肝炎的不良反应及疗效分析[J].中国医院药学杂志,2015,35(8):722-725
[3] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015更新版)[J].肝脏,2015,20(12):915-932
[4] 郑飞跃,吴燕,饶跃峰,等.诺氏评估量表在药物不良反应评价中的作用及实例分析[J].中国药学杂志,2012,47(8):650-652
[5] 国家药品不良反应监测中心.药品不良反应报告和监测工作手册[EB/OL].(2012-11-01)[2019-11-20]https://wenku.baidu.com/view/b7957683caaedd3383c4d3f0.html?pn=1
[6] 姚智�N,徐彦贵.槐耳颗粒合用恩替卡韦致严重腹泻1例[J].中国医院药学杂志,2015,35(17):1624-1625
[7] 刘玉凤,熊号峰,刘景院,等.恩替卡韦治疗慢性乙型肝炎患者导致横纹肌溶解1例[J].中国肝脏病杂志(电子版),2017,9(1):91-93
[8] 孙文庆,梁浩.氢氯吡格雷联合恩替卡韦致血小板减少1例[J].山东医药,2015,55(48):108
[9] 莫国生,蔡永静,吴旭光,等.恩替卡韦、利奈唑胺致乳酸性酸中毒死亡一例[J].中华传染病杂志,2012,30(8):483-483
[10] 贺淑萍.肝病流行病学特征分析及慢性乙型肝炎症状分布示范研究[D].武汉:湖北中医药大学硕士学位论文,2015
[11]Ott JJ,Stevens GA,Groeger J,et al.Global epidemiology of hepatitis B virus infection:New estimates of age-specific HBsAg seroprevalence and endemicity[J].Vaccine,2012,30(12):2212-2219
[12]Manns MP,Akarca US,Chang TT,et al.Long-term safety and tolerability of entecavir in patients with chronic hepatitis B in the rollover study ETV-901[J].Expert Opin Drug Saf,2012,11(3):361-368
[13]Fung J,Seto WK,Lai CL,et al.Extrahepatic effects of nucleoside and nucleotide analogues in chronic hepatitis B treatment[J].J Gastroenterol Hepatol,2014,29(3):428-43
[14]Lai CL,Ahn SH,Lee KS,et al.Phase IIb multicentred randomised trial of besifovir (LB80380) versus entecavir in Asian patients with chronic hepatitis B[J].Gut,2014,63(6):996-1004
[15]Cheung K,Lee SS,Raman M.Prevalence andmechanisms of malnutrition in patients with advanced liver disease,and nutrition management strategies[J].Clin Gastroenterol Hepatol,2012,10(2):117-125
[16] 宋芳娇,游绍莉,辛绍杰.终末期肝病营养代谢特点[J].实用肝脏病杂志,2017,20(5):520-522
[17] 李晨,游绍莉,吕飒,等.恩替卡韦导致乙型肝炎肝硬化患者周围神经病变临床特征[J].实用肝脏病杂志,2016,19(2):200-203
[18] 张晓红,吴元凯,曹红,等.恩替卡韦治疗乙型肝炎肝硬化并发周围神经病3例[J].中华肝脏病杂志,2012,20(9):707-708
[19]Dolce V,Fiermonte G,Runswick MJ,et al.The human mitochondrial deoxynucleotide carrier and its role in the toxicity of nucleoside antivirals[J].Proc Natl Acad Sci USA,2001,98(5):2284-2288
[20]Torres PA,Helmstetter JA,Kaye AM,et al.Rhabdomyolysis:Pathogenesis,Diagnosis,and Treatment[J].Ochsner Journal,2015,15(1):58-69
[21]Bagley WH,Yang H,Shah KH.Rhabdomyolysis[J].Intern Emerg Med,2007,2(3):210-218
[22]Nance JR,Mammen AL.Diagnostic evaluation of rhabdomyolysis[J].Muscle Nerve,2015,51(6):793-810
[23] 刘培景,佟婉红,杨莉.他汀类与核苷类药物所致横纹肌溶解症及其防治[J].药品评价,2012,9(20):38-40,43
[24]Yi Z,Tang S,Liu F,et al.Evaluation on telbivudine-associated rhabdomyolysis[J].Journal of Chinese Pharmaceutical Sciences,2016,25(1):66-72
[25] 徐艳萍,方洪元,纪岩文.淋巴细胞转化试验在药疹诊断中的应用[J].中国麻风皮肤病杂志,2008,24(11):892-894
[26]Takahashi R,Kano Y,Yamazaki Y,et al.Defectiveregulatory T cells In patients with severe drug eruptions:timing of the dysfunction Is associated with the pathological phenotype and outcome[J].J Immunol,2009,182(12):8071-8079
[27]Zhang JY,Song CH,Shi F,et al.Decreasedratio of Treg cells to Th17 cells correlates with HBV DNA suppression in chronic hepatitis B patients undergoing entecavir treatment[J].PloS One,2010,5(11):e13869
[28]Kaniwa N,Saito Y,Aihara M,et al.HLA-B*1511 is a risk factor for carbamazepine-induced Stevens-Johnson syndrome and toxic epidermal necrolysis in Japanese patients[J].Epilepsia,2010,51(12):2461-2465
[29] 武东,汪晓娟,汪小五,等.104例住院患者药源性血小板减少症不良反应报告分析[J].中国医院药学杂志,2019,39(17):1766-1771
[30]Yohannan B,Luu DCN,Feldman M.Entecavir-Associated Thrombocytopenia:A Case Report and Review of the Pathophysiology,Diagnosis,and Treatment of a Rare but Reversible Cause of Thrombocytopenia.[J].Case Rep Hematol,2019,2019:4319148
[31]Kim JT,Jeong HW,Choi KH,et al.Delayed hypersensitivity reaction resulting in maculopapular-type eruption due to entecavir in the treatment of chronic hepatitis B[J].World J Gastroenterol,2014 ,20(42):15931-15936
[32]Aster RH,Curtis BR,Mcfarland JG,et al.Drug-induced immune thrombocytopenia.pathogenesis,diagnosis and management[J].J Thromb Haemost,2009,7(6):911-918
[33] 郜桂菊,林可可,肖江,等.艾滋病患者HAART致高乳酸血症及乳酸酸中毒10例临床分析[J].中国皮肤性病学杂志,2012,26(2):141-143,152
[34] 戴茂林,何锐,王丹,等.恩替卡韦治疗乙型肝炎肝衰竭的安全性初步观察[J].实用肝脏病杂志,2012,15(4):84-85
[35]Lange CM,Bojunga J,Hofmann WP,et al.Severe lactic acidosis during treatment of chronic hepatitis B with entecavir in patients with impaired liver function[J].Hepatology,2009,50(6):2001-2006
[36] 李亚萍,张俊林.慢性重型乙肝患者血乳酸水平变化及核苷类抗病毒治疗的疗效分析[J].安徽医药,2014,18(1):152-154
[37]Revelly JP,Tappy L,Martinez A,et al.Lactate and glucose metabolism in severe sepsis and cardiogenic shock[J].Crit Care Med,2005,33(10):2235-2240
[38] 陈婧,胡瑾华,刘晓燕,等.HBV相关慢加急性肝衰竭患者血乳酸水平影响因素分析[J].传染病信息,2011,24(3):156-158,184
[39]Garrabou G,Soriano A,Lopez S,et al.Reversibleinhibition of mitochondrial protein synthesis during linezolid-Related hyperlactatemia[J].Antimicrob Agents Chemother,2007,51(3):962,967

