
Abstract:OBJECTIVE To analyze and discuss the stability of different administration ways of omeprazole sodium for injection with transfusion fluid. METHODS Simulated 2 administration ways of omeprazole sodium for intravenous infusion and intravenous injection. The pH value at different periods was determined with pH meter, the differences of full absorbance value using 2 administration ways were measured by UV. Then the contents and the changes of omeprazole sodium were calculated. RESULTS The formulation for injection could only be used for intravenous injection and should be used as fast as possible after diluting as it decreased significantly after 3 h. And the other formulation remained stable within 6 h and could be used for intravenous infusion. CONCLUSION Due to different administration ways of omeprazole, the stability of 2 formulations vary obviously. So it shall follow the instructions of administration ways of these 2 drugs of omeprazole sodium.
Keyword:omeprazole sodium for injection;administration;stability;
质子泵抑制剂具有抑制H /K -ATP酶的独特作用, 可强烈、持久地抑制任何刺激所引起的胃酸分泌, 是目前预防和治疗消化性溃疡、反流性食管炎等胃肠道疾病的主要药物[1,2]。奥美拉唑属于第1代质子泵抑制剂, 因疗效显着、复发率低、不良反应少, 临床应用日趋广泛[3,4,5]。奥美拉唑本身对酸不稳定, 直接口服容易被胃酸破坏, 通常采用肠溶剂型以减少其在胃内的降解。生物药剂学和药理机制特点使口服奥美拉唑起效慢 (平均1~5 h) , 也常常不能达到持续抑酸的效果。因此临床上为快速达到治疗效果, 需要静脉使用奥美拉唑制剂[6]。不同厂家的注射剂型奥美拉唑钠包括静脉推注和静脉滴注2种, 导致临床在使用时往往会出现滴注与推注混用、溶媒选择混乱等问题[7]。以往国内研究多集中在注射用奥美拉唑制剂溶媒选择及稳定性上, 但对奥美拉唑同一制剂的不同给药方式在临床实际使用过程中的稳定性研究较少。因此, 本研究通过比较常见的2种奥美拉唑注射剂型—奥克®和奥西康®不同临床输注方式的稳定性, 帮助优化药物治疗方案、规范临床给药行为, 以促进临床合理用药。
1、仪器与试药
奥美拉唑制剂A[奥克®, 常州四药制药有限公司, 批号:20170126G8;规格:40 mg (以C17H19N3O3S计) ];奥美拉唑制剂B[奥西康®, 江苏奥赛康药业股份有限公司, 批号:17010912;规格:40 mg (以奥美拉唑计) ];0.9%氯化钠注射液 (百特制药有限公司, 批号:CS1701010;规格:100 mL) ;奥美拉唑对照品 (中国食品药品检定研究院, 批号:100367-201305;纯度:99.9%) 。
2、方法与结果
2.1、样品的制备
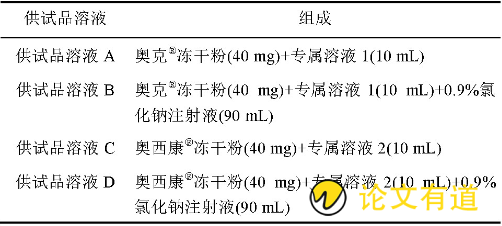
精密称取奥美拉唑对照品40 mg, 加入8 m L0.9%氯化钠注射液稀释至5 mg·mL- (16) , 作为储备液。取奥美拉唑制剂A 40 mg, 吸取10 mL专属溶液溶解, 作为供试品溶液A;另取奥美拉唑制剂A40 mg, 精密吸取10 mL专属溶液溶解, 而后加入0.9%氯化钠注射液稀释至100 mL, 作为供试品溶液B;取奥美拉唑制剂B 40 mg, 精密吸取10 mL专属溶液进行溶解, 作为供试品溶液C;另奥美拉唑制剂B 40 mg, 精密吸取10 mL专属溶液进行溶解, 而后加入0.9%氯化钠注射液稀释至100 mL, 作为供试品溶液D。各种供试品溶液配制组成见表1 (冻干粉质量按C17H19N3O3S计) 。
表1 各供试品溶液配制组成
2.2、实验条件
测定波长为305 nm, 溶剂为0.9%氯化钠注射液的奥美拉唑含量, 其中空白对照为0.9%氯化钠注射液。测定药物的吸光度值, 药物含量比C (%) = (Ax/A0) ×100%。其中, A0为初始供试品溶液吸光度;Ax为配置后各供试品溶液采样点吸光度, 推算药物相对浓度比。
2.3、线性试验
精密量取储备液0.5 mL, 加入4.5 mL 0.9%氯化钠注射液稀释, 摇匀, 使奥美拉唑溶度为0.5 mg·mL- (16) , 作为溶液X。取6只试管, 分别加入4.5, 5.5, 6.5, 7.5, 8.5, 9.5 m L的0.9%氯化钠注射液, 向每只试管精密加入0.5 m L溶液X, 配制成奥美拉唑浓度分别为0.025, 0.027 78, 0.032 15, 0.035 7, 0.041 6, 0.05 mg·mL- (16) 的溶液, 以0.9%氯化钠注射液为空白对照, UV分别测定各溶液的吸光度A。以奥美拉唑浓度 (C) 为横坐标, 吸光度 (A) 为纵坐标, 绘制标准曲线, 计算回归方程为A=26.429C 0.232, r=0.997 2 (n=5) 。表明奥美拉唑在浓度为0.025~0.05 mg·mL- (16) 内线性关系良好。
2.4、仪器精密度和重复性试验
取“2.3”项下溶液X 0.5 mL, 用0.9%氯化钠注射液稀释至0.025 mg·mL- (16) , UV重复测定吸光度5次。取奥美拉唑制剂A和B同批次样品适量, 按“2.1”项下方法配制成供试品溶液A和C, 然后稀释至浓度0.025 mg·mL- (16) , UV重复测定吸光度5次, 考察重复性。结果显示, 奥美拉唑对照品溶液精密度RSD=0.19%, 供试品溶液A的重复性RSD=0.24%, 供试品溶液B的重复性RSD=0.28%, 说明本方法的精密度和重复性良好。
2.5、稳定性试验
从供试品溶液A、B、C、D配制完成开始计时, 分别于0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 24 h观察4种供试品的颜色变化, 测量记录其pH值, 并用UV测定其吸光度A, 从而计算相对百分含量的变化 (以0 h的奥美拉唑含量为100%) 。记录每个时间点4种供试品溶液的颜色情况、pH值以及吸光度A。
2.5.1、各供试品溶液配制后24 h内p H值变化
各供试品溶液配制后p H值变化见表2, 各供试品溶液的p H随时间变化均呈现下降趋势。在常规用药配制后4 h内, 按照说明书标准用法配制的供试品溶液A和D分别比非按照说明书标准用法配制的供试品溶液B和C的p H值下降幅度和趋势均较小。供试品溶液A、C、D的p H值在配制后24 h内均在4~9内, 符合静脉制剂使用要求。但供试品溶液B的p H值在配制2 h后p H<8, 可能导致奥美拉唑稳定性问题, 供试品溶液C则一直较高, 24 h内p H>9.0。
表2 各供试品溶液配制后pH值变化结果

2.5.2、各供试品溶液配制后24 h内吸光度和相对浓度变化
奥克®和奥西康®2种用法相对浓度比与时间的关系见表3。由表中可以看出, 供试品溶液A的吸光度和相对浓度均高于供试品溶液B, 同样, 供试品溶液D的吸光度和相对浓度均高于供试品溶液C。同时供试品溶液A在3 h后相对浓度即降低至<98.5%, 9 h后更是减低至94%左右, 而供试品溶液D则可维持浓度在98%以上10 h, 提示同一剂型, 临床使用方式不同, 其药物稳定性也不同。
3、讨论
奥美拉唑本身的化学性质不稳定, 遇酸、热、光照和氧化剂等均易变质降解, 尤其对pH敏感, 其在碱性环境中较稳定, 且随着pH的增加, 稳定性亦增大。如在pH<8时, 则容易发生变色或产生不溶性沉淀物[8]。一般注射剂型的pH值范围在4~9, pH过高或者过低的注射制剂都易对血管产生刺激性[9]。目前2种国产注射用奥美拉唑钠均为白色或类白色疏松块状物或粉末, 其pH值一般较高 (10.1~11.1) , 并且采取临用时使用pH较低的专属溶剂进行配制的方式保证药物稳定性[10], 结果见表4。黄艳等[11]研究表明, pH值对奥美拉唑的稳定性具有很大影响, 溶液pH值<7.0时极不稳定;pH值在7.0~8.0之间时, 出现颜色变化, 但降解并不明显;而溶液pH值在8.0~10.0之间时奥美拉唑在4 h内是稳定的。供静脉滴注用的奥西康®注射制剂则考虑长期滴注对血管的刺激性, 辅料用适量氢氧化钠或盐酸调节pH值至3.5~5.5, 同时为了避免与使用大量溶媒稀释时pH值降低而导致的药物氧化变质, 从而增加了依地酸二钠作为稳定剂, 确保了药物在长期滴注过程中的稳定性[12]。而供静脉推注奥克®制剂则因稀释剂用量小, 推注时间短且辅料中有含助溶剂聚乙二醇400, 但是含有pH调节剂磷酸二氢钠、氢氧化钠的专属溶媒pH值为5.0~8.0, 盐浓度和pH值均较奥西康®高且未加入EDTA-2Na作为稳定剂, 其长期稳定性较奥西康®差。文献中Ekpe等[13]研究也发现奥美拉唑的降解速率与pH值和盐浓度有关系, 这与本研究的结果是一致的。
表3 各供试品溶液配制后24 h内吸光度及相对浓度变化结果
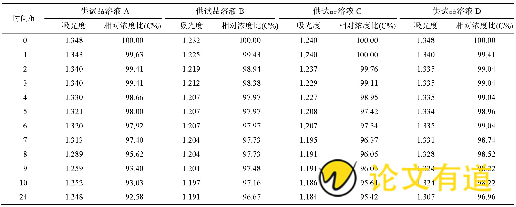
表4 不同厂家注射用奥美拉唑剂型和临床使用注意事项总结

关于奥美拉唑钠含量的测定方法, 中国药典2015年版中注射用奥美拉唑钠含量测定采用HPLC, 专一性更强。但是赵海宇等[14]报道UV测定操作简便, 适用于大批次快速含量测定, 检验结果和HPLC一致。因此本研究采用UV测定奥美拉唑相对含量, 能满足试验对药物含量测定的评估要求。
对于注射用奥美拉唑钠采用非药品说明书推荐方法配制的药物的稳定性, 文献报道甚少, 而药品说明书亦没有对改换其他输注方式有明确的警示。本研究按照临床使用习惯, 对奥美拉唑制剂的静脉滴注和静脉推注方式的稳定性进行考察。实验结果表明, 奥克®配制为静推液时, 其pH在8.0~9.0之间, 较稳定, 但是在3 h后相对浓度降低加速, 提示其不适合长期维持给药。而奥西康®配制为静脉推注液时, 其pH在9.0~10.0之间, pH值过高, 对血管刺激性较强;按照说明书配制方法配制成静脉滴注液时, pH在8~9之间, 较稳定且在10 h内其含量基本>98%, 比较适合静脉滴注条件, 并较奥克®静脉推注制剂适合临床微泵给药, 但也要求现配现用, 配制液保存加使用时间不宜超过4 h。若奥西康®用于静脉推注, 其pH>10, 虽然较稳定, 但是碱性较强, 血管刺激较大, 因此不适于直接静脉推注。
4、结论
2种注射用奥美拉唑的临床给药方式不同, 其稳定性有较大差别。注射用奥美拉唑钠pH值范围较大, 各生产厂家pH值各不相同, pH值变化可能引起沉淀析出、变色反应或加速药物分解等。本研究结果显示, 临床的不同使用方式直接影响其pH值以及稳定性, 进而影响临床用药不良反应的发生、患者耐受性以及药物治疗效果, 临床医师应严格根据药品说明书指示用药。
参考文献
[1]ZHI X R, SONG H J, WANG M, et al.Compatibility stability of esomeprazole sodium for injection[J].Chin J Mod Appl Pharm (中国现代应用药学) , 2017, 34 (12) :1727-1730.
[2]SHI X X, ZHENG S B.Research progress on application safety of long term proton pump inhibitor[J].Chin J New Drugs Clin Rem (中国新药与临床杂志) , 2016, 35 (6) :387-392.
[3]刘鹏.质子泵抑制剂的研究进展[J].临床合理用药杂志, 2014, 30 (35) :96-97.
[4]杜喜维.氯吡格雷与奥美拉唑联用的合理性探讨[J].医药导报, 2016, 35 (S1) :145-146.
[5]ZHANG Y, ZHU L Q, QI F, et al.A study of drug-drug interactions between voriconazole and omeprazole in combination[J].Chin J New Drugs (中国新药杂志) , 2017, 26 (17) :2097-2100.
[6]DING Q M, LU J.Stability and safety of proton pump inhibitor injections[J].Drug Eval (药品评价) , 2012, 9 (14) :24-27.
[7]张涛.不同给药途径不同剂量奥美拉唑抑制胃酸的临床疗效与不良反应[J].中国药物与临床, 2017, 17 (10) :1512-1514.
[8]李冉, 王雪娇, 刘妍, 等.奥美拉唑钠相关变色反应原因分析及护理对策的研究进展[J].中华现代护理杂志, 2015, 21 (21) :2602-2604.
[9]张丽华.注射剂药品说明书中增加值范围标注的作用[J].临床合理用药杂志, 2015, 8 (7C) :99.
[10]孙艳飞.注射用奥美拉唑在输液中的配伍稳定性及联合用药配伍禁忌性研究[J].北方药学, 2017, 14 (9) :190-191.
[11]HUANG Y, HE H X, ZHOU Y D, et al.Observation on the stability of omeprazole sodium for injection combined with 4kinds of common solvents[J].China Pharm (中国药房) , 2015, 26 (14) :1948-1949.
[12]ZHAO C S, WANG X D.Rational preparation and usage of omeprazole for intravenous drip[J].China Pharm (中国药业) , 2017, 26 (19) :85-87.
[13]EKPE A, JACOBSEN T.Effect of various salts on the stability of lansoprazole, omeprazole, and pantoprazole as determined by high-performance liquid chromatography[J].Drug Dev Ind Pharm, 1999, 25 (9) :1057-1065.
[14]赵海宇, 赖丽丽.紫外-可见分光光度法在注射用奥美拉唑钠检验中的应用[J].中国现代药物应用, 2017, 11 (4) :187-188.

