摘要:【目的】利用灰岩金线莲种子无菌播种进行组培苗生产,为其工厂化组培育苗提供参考。【方法】采用灰岩金线莲种子为外植体,以MS或1/2MS为基本培养基,探讨不同激素组合对外植体进行无菌播种、原球茎增殖、丛生芽分化及生根壮苗的影响。【结果】采用0.1%升汞处理灰岩金线莲蒴果20min,灭菌率可达100%,且种子萌发不受影响。在种子萌发培养基中添加香蕉泥有利于种子萌发,最适合种子萌发的培养基为1/2MS 0.5mg/L6-BA 0.2mg/LNAA 60g/L香蕉泥;在原球茎增殖培养中,低浓度的6-BA和NAA有利于灰岩金线莲原球茎增殖,最适合原球茎增殖的培养基为1/2MS 0.2mg/L6-BA 0.2mg/LNAA 60g/L香蕉泥;丛生芽分化的最适培养为MS 2.0mg/L6-BA 0.5mg/LNAA 60g/L香蕉泥 0.1%活性炭,原球茎分化丛生芽较多,生长势最佳;最适合灰岩金线莲生根壮苗的培养基为MS 0.5mg/L6-BA 2.0mg/LNAA 60g/L香蕉泥 0.1%活性炭。【结论】利用灰岩金线莲种子进行无菌播种,通过原球茎增殖和分化,可获得大量优质组培苗,是实现工厂化育苗的理想途径。
关键词:灰岩金线莲;无菌播种;原球茎增殖;丛生芽
0引言
【研究意义】灰岩金线莲(Anoectochilus calcareusAver.)为兰科(Orchidaceae)金线兰属(Anoectochilus)多年生草本植物,是金线莲药材的植物来源之一。金线兰属植物在民间为珍稀名贵中药材,通称金线莲(金效华等,2002;陈谦海,2004),民间多用于治疗糖尿病、高血脂、乙型肝炎等疾病(福建中医药研究所,1982),素有“药王”、“金草”之称,市场需求量大。灰岩金线莲与其他当前种植的金线莲药用功效相似,且其植株大,产量高,是精品药材的优势种。但金线莲属种子在自然环境下极难萌发,野生资源较少,因此,人工种植是对金线莲种质资源保护及缓解供需矛盾的必要手段,而采用组织培养技术进行工厂化育苗,对灰岩金线莲资源的保护和开发利用具有重要意义。【前人研究进展】灰岩金线莲最先发现于越南,目前国内外对该种的研究较少,但近年来对金线兰属其他植物的组织培养研究相对较多。金线莲多以种子、茎段、茎尖为外植体,通过无菌播种、原球茎增殖、不定芽或丛生芽诱导、生根壮苗等阶段实现金线莲的组培快繁。在种子萌发、不定芽诱导及继代增殖培养基的选择上,伍成厚等(2008)利用1/2MS为基本培养基,添加1.0mg/L6-BA和1.0mg/LNAA,播种45d左右金线莲种子可发育成原球茎;罗庆国等(2011)以金线莲植株茎段为外植体,在基本培养基中添加不同浓度的植物生长调节剂,结果表明,不定芽诱导与继代增殖较适宜的培养基分别为MS 1.0mg/L6-BA 1.0mg/LKT,MS 1.0mg/L6-BA 0.5mg/LNAA;罗安雄等(2012)利用1/2MS、MS、N6、KC、Harvais和Fast等6种培养基对福建金线莲进行种子萌发试验,结果发现在MS培养基中的萌发率最高。在外植体的选择方面,祁永琼等(2014)以金线莲顶芽、中部茎段、基部茎段为外植体进行对比试验,结果发现以顶芽为外植体时的诱导率、增殖倍数最高。在不定芽和丛生芽的诱导研究方面,李梅等(2005)在诱导台湾金线莲丛生芽时发现,丛生芽增殖倍数随着6-BA浓度的升高而增高,添加NAA有利于丛生芽的诱导和分化,当添加6-BA5.0mg/L和NAA1.0mg/L时,丛生芽多且较粗壮;罗庆国等(2011)也发现较高浓度的6-BA更有利于金线莲丛生芽的继代增殖。在生根壮苗研究方面,不同品种添加不同的添加物及浓度对生根壮苗的影响不同。李梅等(2005)发现在台湾金线莲生根壮苗培养时添加2%活性炭和150g/L香蕉汁有利于生根;而罗庆国等(2011)认为在金线莲生根壮苗培养基中加入20g/L香蕉泥生根效果最佳。【本研究切入点】金线兰属植物野生资源日渐减少,组织培养是实现大面积人工种植的必要手段。灰岩金线莲为我国新记录种,但国内有关灰岩金线莲组织培养快速繁育的研究尚无文献报道。【拟解决的关键问题】利用灰岩金线莲种子为外植体,采用不同的灭菌方法和激素组合等进行组织培养快速繁育研究,以期获得快速、高效的金线莲组培苗生产技术,为灰岩金线莲的工厂化育苗提供技术支持和理论依据。
1材料与方法
1.1试验材料
供试材料为灰岩金线莲成熟蒴果内种子,采自广西那坡县。
1.2试验方法
1.2.1外植体灭菌 将成熟未开裂的灰岩金线莲蒴果用自来水冲洗表面尘土30min,用洗洁精清洗蒴果表面后置于超净工作台上,用75%酒精浸泡30s,然后随机分成两组:一组材料用10%次氯酸钠加两滴吐温-20,浸泡20或25min,无菌水冲洗4~5次;另一组材料用0.1%升汞加两滴吐温-20,浸泡10或20min,无菌水冲洗4~5次。以上处理以250mL烧瓶为容器,每组浸泡5个蒴果,浸泡液以没过蒴果但不超过烧瓶的1/3容量为宜。以上处理组的种子接种于1/2MS培养基中,每处理组接种10瓶。统计污染率。
1.2.2种子萌发 在培养皿中将灭菌灰岩金线莲蒴果切开,将种子均匀播种于培养基中,暗培养两周,再转到光照培养。种子萌发基本培养基为1/2MS培养基,在培养基中添加不同浓度的6-BA(0.5、0.8、1.0mg/L) NAA(0.2mg/L)、6-BA(1.5、2.0mg/L) NAA(0.5mg/L),以上组合添加香蕉泥(0和60g/L),共10个处理,每处理组接种5瓶。观察种子的萌发情况。萌发率的统计以在显微镜下取不同视野统计100粒种子中的萌发粒,萌发以胚突破种皮形成原球茎为准。
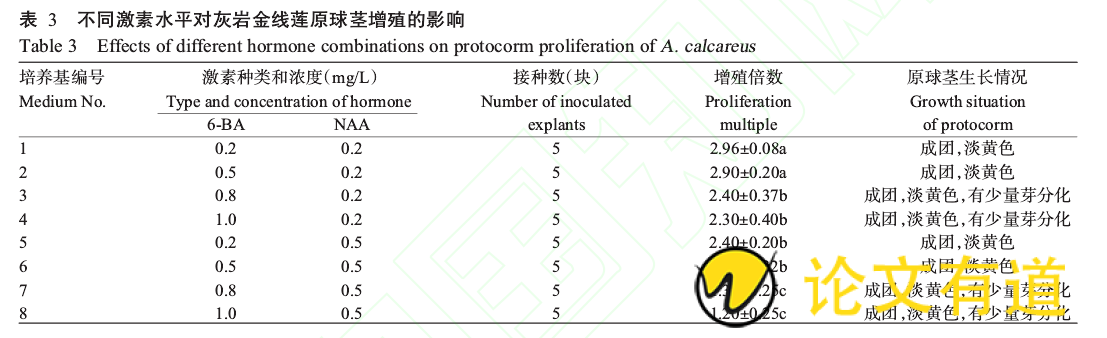
1.2.3原球茎增殖 将萌发的原球茎块切成大小约0.3cm的块状,接种于原球茎增殖培养基中。以1/2MS培养基为基本培养基,添加60g/L香蕉泥,比较不同浓度的6-BA(0.2、0.5、0.8、1.0mg/L)和NAA(0.2、0.5mg/L)(共8个处理)对原球茎增殖的影响,每处理组接种5个原球茎块,观察原球茎的增殖情况。原球茎的增殖率统计以测量增殖的原球茎块大小为准。
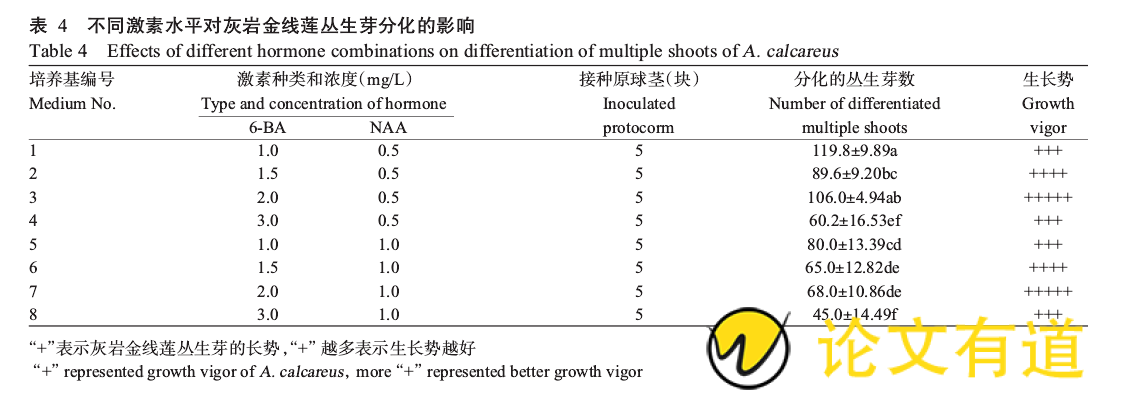
1.2.4丛生芽分化 将0.4cm大小的原球茎块接种于丛生芽分化培养基中,以MS培养基为基本培养基,添加60g/L香蕉泥、0.1%活性炭,比较不同浓度的6-BA(1.0、1.5、2.0、3.0mg/L)和NAA(0.5、1.0mg/L)(共8个处理)对丛生芽分化的影响,每处理组接种5个原球茎块,观察芽的诱导情况,统计分化的丛生芽苗数。
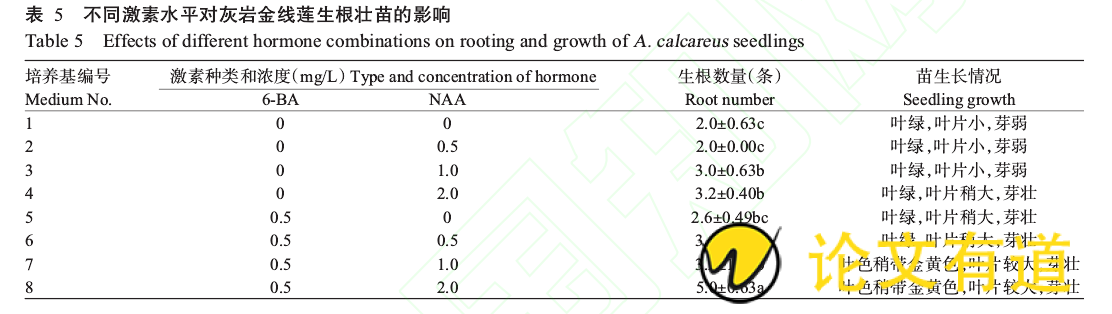
1.2.5生根壮苗 当丛生芽长至4~5cm时分成单株,转接到生根壮苗培养基中,以MS培养基为基本培养基,添加60g/L香蕉泥、0.1%活性炭,比较不同浓度的6-BA(0、0.5mg/L)和NAA(0、0.5、1.0、2.0mg/L)(共8个处理)对生根壮苗的影响,每处理组接种5个芽,观察苗的生长情况及生根情况,50d后将小苗移出培养瓶统计生根条数。
培养条件:MS培养基添加3%蔗糖、7g/L琼脂;1/2MS培养基添加2%蔗糖、7g/L琼脂;培养室温度(25±2)℃,光照强度1000~1200lx,无菌播种后先暗培养7d,然后转到光照培养,种子萌发、原球茎增殖、丛生芽分化培养每天光照12h,生根壮苗培养每天光照14h.
1.3统计分析
试验数据采用Excel2007和SPSS13.0进行整理和统计分析。
2结果与分析
2.1不同灭菌方法对外植体污染率的影响
从表1可看出,外植体经10%次氯酸钠处理20或25min,8d后种子100%污染;0.1%升汞处理10min,7d后种子100%污染,但0.1%升汞处理20min的灭菌率可达100%,且种子萌发的原球茎生长良好,萌发率最高。因此,最适合灰岩金线莲蒴果的灭菌方法是0.1%升汞浸泡20min.

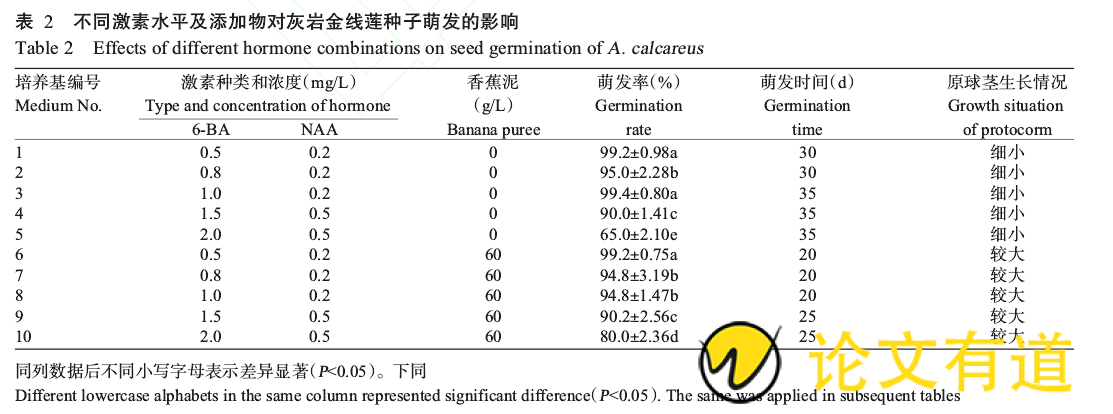
2.2不同激素水平及添加物对种子萌发的影响
将灰岩金线莲种子撒播在添加6-BA和NAA的培养基表面,每隔5d观察1次,结果见表2.播种后20d,6~8号培养基中的种子开始萌发膨大成白色原球茎;播种后60d,1、3、6号培养基的种子萌发率均在99.0%以上,而5号培养基的萌发率仅为65.0%,说明较低浓度的6-BA有利于种子萌发。当6-BA浓度达1.5mg/L、NAA浓度达0.5mg/L时,种子萌发率开始降低;虽然1、3、6号培养基的种子萌发率差异不显着(P>0.05,下同),但在相同的激素水平条件下,添加香蕉泥培养基中的种子提前萌发,且原球茎较大(图1)。因此,最适合灰岩金线莲种子萌发的培养基为:1/2MS 0.5mg/L6-BA 0.2mg/LNAA 60g/L香蕉泥。

2.3不同激素水平对原球茎增殖的影响
将萌发的原球茎块接种到原球茎增殖培养基中,60d后统计增殖倍数。从表3可看出,随着6-BA浓度的增加,原球茎增殖倍数降低;当NAA浓度为0.5mg/L时,增殖倍数明显低于浓度为0.2mg/L时,说明低浓度的6-BA和NAA有利于灰岩金线莲原球茎增殖;当6-BA和NAA浓度增加时,原球茎会有少量芽分化。虽然1、2号培养基中的原球茎增殖倍数差异不显着,但1号培养基6-BA的用量较少,可节约成本,因此,最适合灰岩金线莲原球茎增殖的培养基为:1/2MS 0.2mg/L6-BA 0.2mg/LNAA 60g/L香蕉泥。
2.4不同激素水平对丛生芽分化的影响
将原球茎块接种于丛生芽分化培养基中,60d后统计分化的丛生芽数量。由表4可知,在不同激素水平配比条件下,灰岩金线莲的丛生芽分化数量存在明显差异。6-BA浓度为1.0~2.0mg/L时,在6-BA浓度相同、NAA浓度不同的情况下,分化的丛生芽数差异显着(P<0.05,下同),NAA浓度越高越不利于丛生芽分化;当6-BA浓度为3.0mg/L时,虽然NAA浓度不同,但分化的丛生芽数差异不显着。当NAA浓度为1.0mg/L时,5、6、7号培养基中分化的丛生芽数差异不显着;当NAA浓度为0.5mg/L时,1、3号培养基分化的丛生芽数最多,差异不显着,但3号培养基中丛生芽的长势最好,芽粗壮,叶绿且较大。因此,最适合灰岩金线莲原球茎分化丛生芽的培养基为:MS 2.0mg/L6-BA 0.5mg/LNAA 60g/L香蕉泥 0.1%活性炭,在该培养基下原球茎分化丛生芽较多,生长势最佳(图2)。

2.5不同激素水平对生根壮苗的影响
将灰岩金线莲丛生芽分成单株接种于生根培养基上,接种50d后统计生根数量并观察苗生长情况。从表5可看出,灰岩金线莲组培苗生根数均随NAA浓度的增加而增加,当NAA浓度达2.0mg/L、6-BA浓度为0.5mg/L时生根数量最多(5.0±0.63条),与其他浓度处理组间差异显着,且苗生长健壮,茎粗,叶片大(图3)。因此,最适合灰岩金线莲生根壮苗的培养基为:MS 0.5mg/L6-BA 2.0mg/LNAA 60g/L香蕉泥 0.1%活性炭。

3讨论
本研究对灰岩金线莲蒴果灭菌时进行次氯酸钠和升汞灭菌对比试验,发现升汞较长时间的灭菌效果最佳,种子萌发率达100%.伍成厚等(2008)和黄勇(2010)利用0.1%升汞对金线莲果实的灭菌时间为10min,而本研究效果最佳的灭菌时间为20min,其原因可能是本研究试验材料直接从野外采回,果实表面带有的菌群较多,也可能由于果实表面凸凹不平而导致灭菌时间加长。一般的金线莲组培外植体材料(茎段)升汞灭菌时间为10~18min(罗庆国等,2011;祁永琼等,2014),长时间灭菌会影响外植体的存活率,但金线莲未开裂蒴果有果皮保护,因此本研究中升汞灭菌20min对灰岩金线莲种子的萌发无影响。
香蕉汁、椰乳等天然提取物在兰科植物组培中较常用,如曾宋君等(2004)认为在培养基中添加椰乳能促进白芨种子的萌发与成苗;张铁等(2006)在滇越金线莲种子萌发培养基中添加椰乳,不仅可以提高种子萌发率,而且原球茎分化的苗生长健壮。本研究在种子萌发培养基中添加香蕉泥可使灰岩金线莲种子的萌发时间提前,使原球茎生长健壮,有利于原球茎的增殖及分化。但不同天然提取物在兰科植物组培的各阶段有不同作用。王建明等(2013)发现,添加香蕉泥对金线莲芽苗的增殖及壮苗有促进作用,而添加椰子汁虽然对金线莲芽苗的增殖效果较好,但对壮苗效果较差。
本研究发现低浓度的6-BA和NAA有利于灰岩金线莲原球茎的增殖,与伍成厚等(2008)的研究结果相似,即金线莲原球茎增殖率最高的激素配比为0.2mg/L6-BA 0.5mg/LNAA.在金线莲丛生芽诱导的研究中,前人研究较多的是从茎段腋芽萌发新芽后再诱导丛生芽(罗庆国等,2011),也有利用茎节诱导类原球茎的报道,虽然从原球茎分化丛生芽的增殖倍数较大且从原料数量上也占有优势,但有关的报道较胡琦敏等:灰岩金线莲种子萌发与组培快繁技术研究少。罗晓青等(2014)利用MS和1/2MS培养基对兴仁金线莲进行种子播种对比试验,发现1/2MS培养基上的原球茎能较早分化成丛生芽,但未进行激素配比对比试验。本研究通过不同浓度的6-BA和NAA配比研究,发现较高浓度的6-BA与较低浓度的NAA配比有利于灰岩金线莲原球茎分化丛生芽,且分化的丛生芽数量多而健壮。
组培苗生长健壮,根系发达,移栽后可提高其对外界环境的适应能力和抵抗力。本研究发现,在生根壮苗阶段,高浓度的NAA有利于生根,与一定浓度的6-BA配合使用,可使幼苗生长健壮,叶片大,提高移栽存活率。在NAA的使用浓度方面,本研究NAA的使用浓度为2.0mg/L,赵�h和郭顺星(2011)在福建金线莲生根培养阶段使用的浓度为3.0mg/L,但申刚等(2015)认为不同浓度的NAA对金线莲生根数影响的差异不显着。在生根壮苗阶段,不同产地的同种植物或同属植物对激素的需求量不同可能是由于不同植物之间所含的内源激素不同所致。
4结论
本研究结果表明,利用灰岩金线莲种子进行无菌播种,通过原球茎增殖和分化,可获得大量优质组培苗,是实现工厂化育苗的理想途径。
参考文献:
陈谦海。 2004. 贵州植物志(第十卷)[M]. 贵阳: 贵州科技出版社:343-355.
Chen Q H. 2004. Guizhou Flora(Vol. 10)[M]. Guiyang: GuizhouScience and Technology Publishing House:343-355.
福建中医药研究所。 1982. 福建药物志(第 2 册)[M]. 福州:福建科技出版社:215.
Fujian Institute of Traditional Chinese Medicine. 1982. FujianMedicine(Vol. 2)[M]. Fuzhou: Fujina Science and Tech-nology Publishing House: 215.
黄勇。 2010. 金线莲组织培养新体系建立及优化[J]. 北方园艺,(13):178-179.
Huang Y. 2010. Establishment and optimization of tissue culturesystem of Anoectochilus roxburghii[J]. Northern Horticul-ture,(13): 178-179.
金效华,吉占和,覃海宁,萧丽萍,蹇平。 2002. 贵州兰科植物增补[J]. 植物分类学报, 40(1): 82-88.
Jin X H, Ji Z H, Qin H N, Xiao L P, Jian P. 2002. Novelitiesof the orchidaceae of Guizhou[J]. Acta PhytotaxonomicaSinica, 40(1): 82-88.
李梅,林德钦,张文珠。 2005. 台湾金线莲丛生芽诱导和组培研究[J]. 中国现代实用医学杂志,4(9):8-9.
Li M, Lin D Q, Zhang W Z. 2005. Induction and culture ofclustered shoots of Anoectochilus formosanus[J]. ChineseJournal of Current Practical Medicine, 4(9):8-9.
罗安雄,孟志霞,陈晓梅,郭顺星。 2012. 福建金线莲种子萌发及幼苗培养研究[J]. 中国药学杂志,47(15):1199-1203.
Luo A X, Meng Z X, Chen X M, Guo S X. 2012. Seed germi-nation and young seedling propagation of Anoetochilus rox-burghii[J]. Chinese Pharmaceutical Journal, 47(15):1199-1203.
罗庆国,叶炜,江金兰,谢嫦,李永清。 2011. 金线莲组培快繁技术研究[J]. 南方农业,5(10):43-44.
Luo Q G, Ye W, Jiang J L, Xie C, Li Y Q. 2011. Rapid pro-pagation technology of Anoectochilus roxburghii[J]. SouthChina Agriculture, 5(10):43-44.
罗晓青,申刚,蒙秋伊,张显波,查兰松。 2014. 兴仁金线莲组织培养与快繁试验[J]. 西南农业学报,27(1):331-336.
Luo X Q,Shen G,Meng Q Y,Zhang X B,Zha L S. 2014. Studyon tissue culture and rapid propagation of Anoectochilusxingrenensis[J]. Southwest China Journal of AgriculturalSciences, 27(1):331-336.
祁永琼,王丽莉,罗瑞芳,李开云。 2014. 金线莲不同外植体组织培养成苗技术探讨[J]. 江苏农业科学,42(8):57-59.
Qi Y Q, Wang L L, Luo R F, Li K Y. 2014. Tissue culturetechnology of different explants from Anoectochilus rox-burghii[J]. Jiangsu Agricultural Sciences, 42(8):57-59.
申刚,刘荣,罗晓青,张显波。 2015. 金线莲组培苗生根培养基配方及移栽基质探究[J]. 农技服务,32(12):103.
Shen G, Liu R, Luo X Q, Zhang X B. 2015. Culture mediumformula for rooting and transplanting substrate of Anoec-tochilus roxburghii tissue-cultured seedling[J]. AgriculturalTechnology Service, 32(12): 103.
王建明,王松良,詹巧杰,古力,康智明,张金荣,林长芹。 2013.金线莲组织培养的条件优化研究[J]. 中国现代中药,15(1):45-49.
Wang J M, Wang S L, Zhan Q J, Gu L, Kang Z M, Zhang JR, Lin C Q. 2013. Study on condition optimization of tissueculture for Golden Thread Lotus(GTL)[J]. Modern ChineseMedicine, 15(1):45-49.
伍成厚,冯毅敏,贺漫媚,陈妙贤,朱纯,叶振华。 2008. 金线莲种子培养的研究[J]. 中国野生植物资源,27(1):47-50.
Wu C H, Feng Y M, He M M, Chen M X, Zhu C, Ye Z H.2008. Seeds culture of Anoectochilus roxburghii[J]. Chi-nese Wild Plant Resources,27(1):47-50.
曾宋君,黄向力,陈之林,陈建通,段俊。 2004. 白及的无菌播种和组织培养研究[J]. 中药材,27(9):625-627.
Zeng S J, Huang X L, Chen Z L, Chen J T, Duan J. 2004. Asep-sis sowing and tissue culture of Bletilla striata[J]. Journal ofChinese Medicinal Materials, 27(9):625-627.
张铁,田雪琪,李彬。 2006. 滇越金线莲快速繁殖技术研究[J].文山示范高等专科学校学报,19(3):110-114.
Zhang T, Tian X Q, Li B. 2006. A Study on embryo germinationand proliferation in vitro of Anoectochilus chapaesis[J]. Jour-nal of Wenshan Teachers College, 19(3):110-114.
赵�h, 郭顺星。 2011. 两种金线莲组培苗的促根试验研究[J].辽宁农业科学,(3):40-42.
Zhao Y, Guo S X. 2011. Root inducing of tissue-cultured seedlingof A. formosanus and A. roxburghii[J]. Liaoning Agricul-tural Sciences,(3):40-42.

