摘 要: 膜蛋白承担了生物膜的主要功能,是新药研发最重要的靶点群,大约60%的药物以膜蛋白为靶点。由于膜蛋白在水溶液中有明显的聚集和变性倾向,在体外很难模拟维持膜蛋白正确构象的类膜环境,导致膜蛋白的结构和功能以及相关配体药物的研究远远滞后于水溶性蛋白。膜蛋白稳定技术对于建立高专属性、高灵敏度和高通量的膜蛋白配体药物筛选方法具有重要的意义。本文综述了目前用于稳定分离纯化膜蛋白的一些技术,包括洗涤剂、人造膜、聚合物、慢病毒颗粒等,以及这些技术在药物筛选中的具体应用。
关键词 : 膜蛋白;稳定技术;洗涤剂;人造膜;聚合物;慢病毒颗粒;药物筛选;
Abstract: Membrane proteins are the main undertakers of biofilm function, and also the most important target group for innovative drug discovery and research. About 60% of drugs targets are membrane proteins. Due to the obvious aggregation and denaturation tendency of membrane proteins in aqueous solution, it is difficult to simulate the membrane like environment to maintain the correct conformation of membrane proteins in vitro, which results in the slower-growing research on the structure and function of membrane proteins and related ligand drugs than that of water-soluble proteins. Membrane protein stabilization technology is the premise of establishing high specificity, high sensitivity and high throughput drug screening methods for membrane protein ligands, which is of great significance. In this paper, some techniques for stable separation and purification of membrane proteins are reviewed, including detergents, artificial membranes, polymers, lentiviral particles and so on, as well as their specific applications in drug screening.
Keyword: membrane protein; stabilization technology; detergent; artificial membrane; polymer; lentivirus particles; drug screening;
膜蛋白(membrane proteins, MPs)是细胞膜的重要组成部分,在物质运输、信号转导和细胞间识别等多种细胞功能中发挥着重要作用。人类基因组中编码的MPs约占总蛋白质组的25%。这些MPs与囊性纤维化、动脉粥样硬化、帕金森病和阿尔茨海默病等多种疾病相关[1]。MPs暴露在细胞外的区域是许多药物作用的潜在靶点,据估计MPs是60%药物的靶点[2],如ABC转运蛋白[3]、核苷转运蛋白[4]、G蛋白偶联受体[5]、微囊蛋白-1[6]等。一些MPs可调节细胞反应使药物直接进入细胞内,或者以通道的形式帮助药物进入细胞内部发挥药效;而另一些MPs则主动从细胞中泵出药物,因此MPs可以极大地影响药物的治疗效果。

作为最具前景的药物潜在靶点群,MPs的分离纯化对于其结构和功能研究以及新药研发具有重大意义。研究发现MPs需要维持脂质双分子层或类脂环境才可以保持其天然构象,但是这种环境在体外很难模拟;并且MPs在水溶液中还有明显的聚集和变性倾向,因此MPs的结构生物学研究十分滞后。目前已知结构的蛋白中只有2%~3%是MPs[7]。此外,MPs的表达量一般都较低,难以被分离纯化得到足够量的目标MPs。如何将MPs分离纯化并获得稳定的结构是MPs研究的难点问题。针对MPs脱离天然膜环境后易聚集和变性的现象,早期研究者提出了以表面活性剂为主的洗涤剂策略,利用其形成的胶束来分离MPs,但在应用过程中存在一些问题[8];进而提出了以脂质体、纳米盘等两亲体系来模拟天然膜环境,一定程度上保证了MPs在分离纯化过程中构象和功能的完整性[9];近年来还出现了保护MPs周围局部脂质环境的聚合物稳定技术[10]、慢病毒颗粒稳定技术[11]等。
本文针对MPs稳定技术进行综述,包括传统和新型的洗涤剂、人造膜、聚合物、慢病毒颗粒等稳定技术以及其在药物筛选中的具体应用,为下游MPs结构和功能研究提供可靠的技术支持,促进以MPs为靶点的新药研发和中药活性成分的高通量筛选。
1 、洗涤剂稳定技术(detergent)
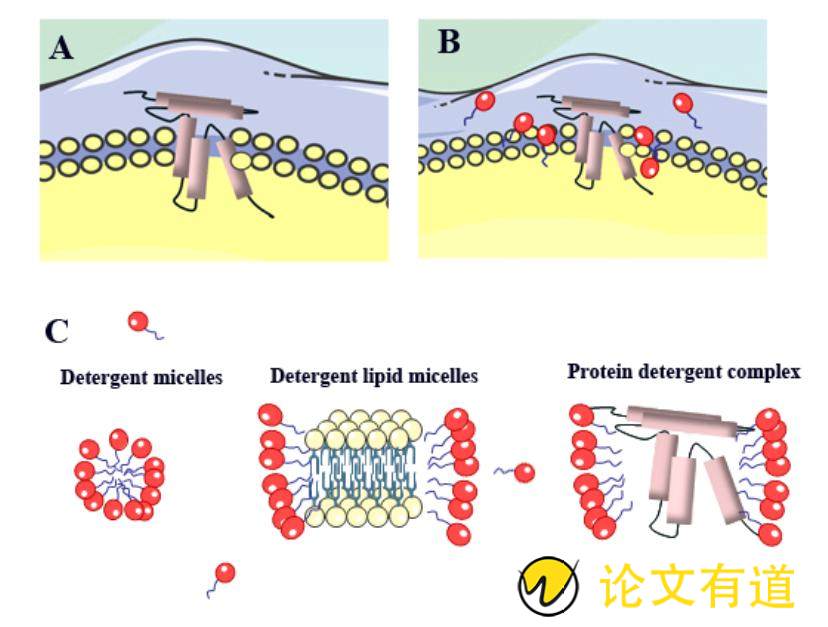
早期的MPs稳定主要采用洗涤剂策略实现。洗涤剂是以表面活性剂为主的一类混合物的统称,它能降低两种不混溶液体之间的界面张力[12]。洗涤剂的整体分子结构由亲水的极性头基团和疏水的非极性尾基团组成。水溶液中,细胞膜以脂质双分子层的形式存在,洗涤剂分子在高于临界胶束浓度(critical micelle concentration, CMC)时以胶束形式存在。当细胞膜和洗涤剂胶束混合时,洗涤剂分子首先以非协同的方式结合在细胞膜表面,随着洗涤剂数量的增加,洗涤剂分子从细胞膜表面掺入进脂质双分子层内部,此时的非协同结合转变为协同结合,洗涤剂与细胞膜的协同和非协同结合称为跨双分子层机制[13]。随着越来越多的洗涤剂被合并到膜中,脂-洗涤剂混合胶束形成,细胞膜被裂解,洗涤剂成功地提取MPs形成胶束,过程如图1所示。
Figure 1 The process of membrane protein separation by detergent. A: Membrane protein embedded in lipid bilayer; B: Detergent interacts with lipid bilayer; C: Dissolution of lipid bilayer and extraction of membrane protein
1.1 、传统洗涤剂
传统洗涤剂包括N-辛基-β-D-吡喃葡萄糖苷(N-octyl-β-D-glucopyranoside,OG)、N-癸基-β-D-麦芽糖苷(N-decyl-β-D-maltoside,DM)、N-十二烷基-β-D-麦芽糖苷(N-dodecyl-β-D-maltoside,DDM)、N-壬基-β-D-吡喃葡萄糖苷(N-nonyl-β-D-pyranoglucoside,NG)和月桂基二甲基氧化胺(lauryl dimethylamine oxide,LDAO)。其中DDM作为最经典的洗涤剂,通常是MPs提取的首选洗涤剂[14]。不同洗涤剂对于MPs的分离纯化有各自不同的倾向性。Iwata等[15]发现DDM对转运蛋白和呼吸复合物的分离作用较好,而OG对通道蛋白的分离作用较好。Newstead等[16]发现LDAO会导致大多数的转运蛋白聚集。Simon等[17]的研究表明DDM、DM、OG、NG对于α螺旋蛋白提取效率相近。有报道[18]称在LDAO中,电压依赖性阴离子通道蛋白可保持稳定结构。此外,不同类型的洗涤剂提取MPs时所需的磷酸盐浓度也不同。Metola等[19]研究发现在较高的磷酸盐浓度时,两性离子型洗涤剂LDAO比非离子型洗涤剂DDM有更高的提取效率。不同类型洗涤剂对蛋白的稳定性也不同,据估计只有20%的MPs能在LDAO中维持稳定[20];相比之下,非离子型洗涤剂DDM中大部分蛋白质稳定性明显优于LDAO,但非离子型洗涤剂的提取效率往往低于两性离子型洗涤剂。在传统洗涤剂的应用过程中,研究者们描述的共性问题在于胶束中的MPs稳定性不高,很难保持MPs的天然构象,限制了MPs结构和功能研究及其下游应用。
1.2 、新型洗涤剂
针对传统洗涤剂中MPs稳定性不高的问题,研究者开发出一系列新型洗涤剂,主要有:环戊烷基麦芽糖苷、杯芳烃基洗涤剂、不对称麦芽糖新戊二醇、线性和支化甘露醇基两亲体、三苯基核麦芽糖苷等。它们与传统洗涤剂相比,能更好地稳定MPs。
Das等[21]制备了一类以环戊烷为核心单元的新型非对映体洗涤剂,即环戊烷基麦芽糖苷(cyclopentyl maltosides, CPMs),并对其稳定几种模型MPs的能力进行了评价。与常规洗涤剂DDM相比,CPMs对包括两个G蛋白偶联受体(G protein-coupled receptors, GPCRs)在内的所有被测MPs表现出更高的稳定性和提取效率。而Hardy等[22]开发的杯芳烃基洗涤剂具有更高的热稳定性。在杯芳烃基洗涤剂中,MPs能保持稳定的温度与经典洗涤剂DDM相比至少提高了30 ℃。Hyoung等[23]制备了一系列的不对称麦芽糖新戊二醇(neopentyl maltose glycols, NMGs),并对它们的MPs溶解和稳定性能进行评估,包括两种G蛋白偶联受体,结果显示与DDM相比,MNGs对所测的MPs有更高的稳定性。此外还有很多比经典洗涤剂DDM性能更好的洗涤剂,如基于间苯二酚的葡萄糖苷和麦芽糖苷的两亲性洗涤剂[24] (分别称为RGAs和RMAs)、三苯基核麦芽糖苷洗涤剂[25](triphenyl maltosides, TPMs)、锡基肌醇苷洗涤剂[26] (tin inositol glycoside, SIGs)等都在一定程度上具有更高的MPs稳定性和提取效率。Hussain等[27]设计合成了线性和支化甘露醇基两亲体(mannitol amphiphilics, MNAs),通过比较研究表明,大多数支化MNAs在MPs稳定性方面都优于线性MNAs。
尽管新型洗涤剂在一定程度上提高了分离纯化过程中MPs的稳定性,但新旧洗涤剂都有一些共性的缺陷[28]:①对于未知性质MPs的分离、纯化和稳定的洗涤剂选择,需要进行广泛筛选;②洗涤剂以形成胶束的形式分离纯化MPs,常常会导致MPs失去与脂质和其他蛋白质的天然相互作用;③稳定分离MPs效果好的洗涤剂有时会干扰下游应用。因此,无法预测哪种洗涤剂对给定的蛋白质最有效,需要通过反复实验来确定。
2 、人造膜稳定技术
针对洗涤剂策略的不足,研究者们提出了新的模拟天然膜环境的两亲体系的人造膜策略。该策略的灵感来自新兴的纳米科学,充分考虑了磷脂双分子层的复杂性和维持MPs活性的重要性,确保在局部膜环境中稳定地分离纯化MPs。人造膜稳定MPs的基本原理是将二油酰基磷脂酰胆碱、二油酰磷脂酰甘油、棕榈油酰磷脂酰胆碱、胆固醇等细胞膜含有的磷脂类成分,采用不同的反应条件,制备成脂质体、双胞体和纳米圆盘等多种形式,并与纯化或重组的MPs按一定比例混合,即可实现MPs-人造膜镶嵌模型重构。
2.1、 脂质体(liposome)
脂质体是将两性分子如磷脂和鞘脂分散于水相,分子的疏水尾部倾向于聚集在一起,避开水相,而亲水头部暴露在水相,形成具有双分子层结构的封闭囊泡。脂质体可由纯脂质或混合脂质制备,其比例可根据目的蛋白进行调整。脂质体的大小可通过分散制备步骤进行调整,如膨胀[29]、挤压[30]、乳化、超声波、电形成[31]、喷墨形成和冻融循环等。对于MPs中的转运体如核苷转运蛋白,脂质体有其独特的优势。重组脂质体可以通过选择性浓缩脂质体内底物对MPs进行功能完整性测试。同样,如果蛋白脂质体是在底物存在下形成,也可以进行反向评估[32]。此外,脂质体中脂质的比例和种类会极大的影响MPs的活性、稳定性和结晶性能[33]。脂质体可以通过稳定蛋白质折叠、单体和亚单位之间的联系来促进结晶,也可以通过脂质体介导的晶格接触来促进结晶,从而测定MPs的结构和功能以及相应的药物靶点研究。Kurisu等[34]发现与传统磷脂相比,加入非天然脂质二油酰基卵磷脂(DOPC)可以促进了蓝藻细胞色素b6f复合体的结晶。Jidenko等[35]用洗涤剂/DOPC混合物溶解并结晶得到在酵母中过表达的哺乳动物Ca2 -ATP酶。
2.2 、双胞体(bicelles)
双胞体是由长链磷脂和短链脂质(或洗涤剂)混合形成的自组装圆盘结构[36],长链磷脂形成含MPs的双分子层,然后由位于双分子层边缘的短链脂质稳定。目前最常用的组合是二己酰磷脂酰胆碱(DHPC,短脂)和二肉豆蔻酰磷脂酰胆碱(DMPC,长脂)的组合。根据长脂与短脂的比例、温度、pH值和盐浓度的不同,双胞体具有不同的构象。双胞体是介于脂质体囊泡和经典洗涤剂胶束之间的一种中间形态,结合了这两种系统的优点。与脂质体相比,双胞体更容易实现均匀混合;与经典洗涤剂胶束相比,双胞体中洗涤剂用量更低,并且更加接近天然的膜环境[37]。但双胞体也有其局限性,如[DMPC]:[DHPC]的合适比例往往难以控制。在双胞体中洗涤剂交换步骤有时会导致MPs的聚集,存在洗涤剂使用相关问题的限制。
2.3 、纳米盘(nanodisc)
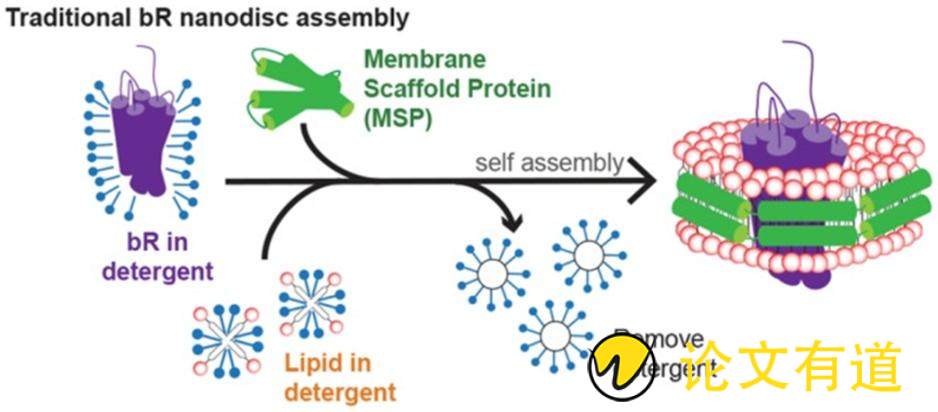
纳米盘由磷脂和两亲性螺旋蛋白,也称膜支架蛋白(membrane scaffold protein, MSP)组成。一般由130~160个磷脂形成含MPs的双分子层,然后由MSP作为与MPs结合的疏水基团保持其天然构象[38]。单个MPs可形成150 kDa大小的纳米盘。组装纳米盘时,首先将MSP按照一定比例与预先溶解在洗涤剂(通常是胆酸钠)中的磷脂混合,孵育一段时间后利用透析或疏水吸附剂去除洗涤剂,随后纳米盘自行组装形成纳米级别类膜结构圆盘[39]。组装包含MPs的纳米盘只需在体系中再加入适量MPs,其自组装过程与空纳米盘相似。包含MPs的纳米盘与空纳米盘通过生化手段进行分离,随后用分子排阻色谱进一步纯化,过程如图2所示[40]。
Figure 2 Self assembly process of nanodisc. After the detergent was removed by dialysis or hydrophobic adsorbent, nanodisc was assembled by itself [40]
对于MPs的稳定分离纯化而言,纳米盘体系可以在溶液中提供类膜环境,它具有和细胞膜一样的脂质组成。与其他人造膜相比,MSP的添加可以更好地稳定MPs的天然构象。应用纳米盘开展的MPs研究较广泛,GPCR家族蛋白β2AR被证明在纳米盘体系中可以保持蛋白的结构完整和功能活性[38]。此外Yao等[41]使用纳米盘研究B细胞淋巴瘤/白血病基因表达的抗凋亡蛋白(BCL-XL)在其膜环境下的构象和功能,结果显示纳米盘并未改变BCL-XL的N端的球状结构,并且增强了其BH3配体的结合活性。针对传统的纳米盘的构型,Nasr等[42]设计了共价环化纳米盘(covalently circularized nanodiscs, CNDs),其较传统纳米盘具有更高的稳定性、可控的直径和形状可调等优点,被应用到电压依赖性阴离子通道蛋白-1(VDAC-1)和G蛋白偶联受体-NRT1上。
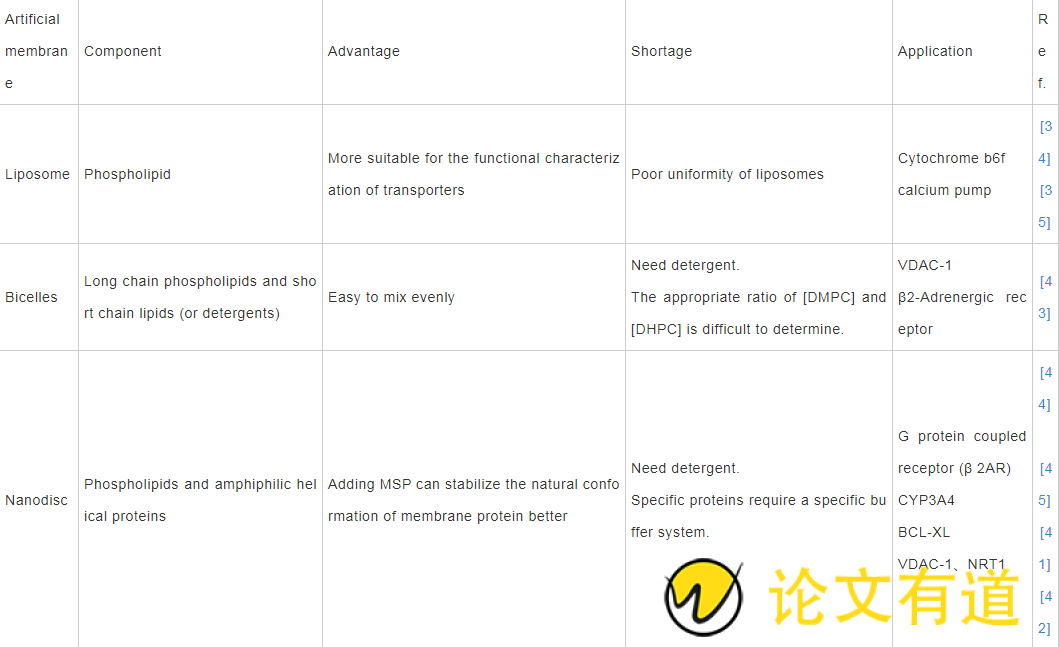
与双胞体一样,纳米盘的第一步是基于洗涤剂的增溶,需要优化所使用的洗涤剂的性质和浓度,这在纳米盘重组中可能造成蛋白质活性损失,因此同样存在洗涤剂使用相关问题的限制。表1[34,35,41,42,43,44,45]比较了脂质体、双胞体、纳米盘的组成及其优缺点。
Table 1 Comparison of different types of artificial films .
3、 聚合物稳定技术
针对洗涤剂和人造膜分离纯化和稳定MPs的不足,研究人员从保护MPs周围局部脂质环境的思路出发,开发出了完全不添加洗涤剂的新方法,采用包括苯乙烯马来酸、二异丁烯马来酸、聚甲基丙烯酸酯等聚合物来稳定含有MPs的纳米级脂质圆盘。
3.1 、苯乙烯-马来酸酐(styrene maleic anhydride, SMA)聚合物
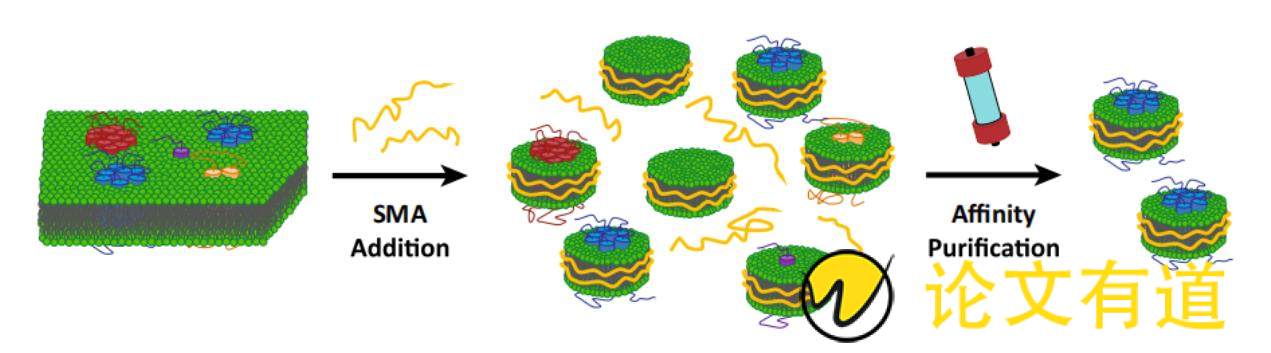
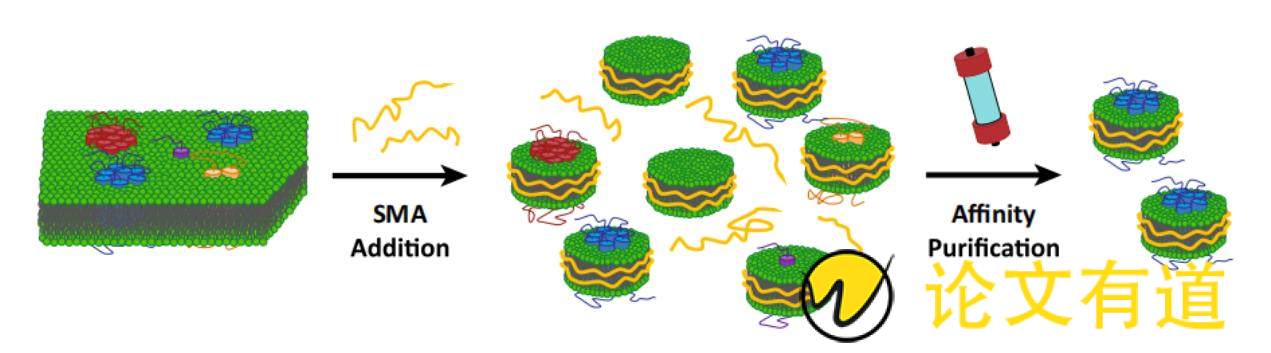
SMA是苯乙烯和马来酸酐通过自由基聚合得到一种性能优良的共聚物,该聚合物由亲水性的马来酸和疏水性的苯乙烯交替组成[46]。SMA和大约140个脂质组成苯乙烯-马来酸酐脂质颗粒(SMA lipid particles, SMALPs)[47]。组装SMALPs时,首先将细胞悬液破碎处理,然后将一定量SMA添加到pH值≥6.5的细胞破碎悬液中,孵育一段时间后可发现该混合体系变澄清,表明SMALPs自组装完成[48],接下去采用光散射技术来检测SMALPs组装完成后的物理参数。Xue等[49]通过研究SMALPs自组装过程发现,SMA共聚物首先将末端的苯乙烯基团结合到膜表面,随后疏水相互作用驱动苯乙烯基团插入脂质双分子层的中心。当SMA共聚物的疏水侧链完全插入时,局部脂质双分子层产生波动,形成小的跨膜孔。随着跨膜孔生长,SMA将羧基定向到跨膜孔上,并且在脂质尾部之间插入苯基来稳定边缘,从而完成SMALPs自组装,SMA提取纯化膜蛋白过程如图3所示[50]。
Figure 3 Extraction of membrane proteins with native lipid environment by SMA. SMA additions leads to the formation of native nanodiscs containing different MPs or only lipid material. Subsequent affinity purification allows for the isolation of native nanodiscs with the protein of interest[50]
目前SMA方法已经成功地应用于稳定和分离纯化离子通道蛋白[51]、转运蛋白[51]、酶[52]、呼吸链复合物[53]以及受体[54]等。当苯乙烯与马来酸的比例为2:1或3:1时,SMA对MPs的分离纯化效果最好。另外SMA的提取效率还受到目标蛋白的大小和蛋白在膜中的包裹密度的影响[46]。与洗涤剂和人造膜相比,SMA的优势在于其通过SMALPs的自发组装将目标蛋白与天然脂质双分子层以及相关蛋白一起提取。这不仅提供了相关蛋白与目标蛋白相互作用的信息,而且还提供了一种识别目标蛋白周围内源性脂质组成的方法。此外,纯化成SMALPs的MPs具有显着的稳定性,在4 ℃时SMALPs至少能保持一周稳定,在经过几轮冻融循环后,SMALPs颗粒完整性和蛋白功能损失最小[55]。
但SMA对低pH和二价阳离子不耐受的特点限制了该策略在MPs下游研究中的应用[56,57],因此人们对SMA进行结构修饰,合成SMA-ED、SMAd-A[58]和SMI[59]等pH值可调和耐受二价阳离子的聚合物脂质纳米盘,有望成功应用于MPs的稳定提取上。
3.2、 二异丁烯-马来酸(diisobutylene maleic acid ,DIBMA)聚合物
SMA对二价阳离子耐受性低,限制了Mg2 和Ca2 等阳离子的使用,而这些阳离子通常用于蛋白质纯化和活性测定的缓冲液中。最近有研究表明,二异丁烯-马来酸(DIBMA)共聚物也能够直接溶解膜,形成DIBMA脂质颗粒(DIBMALPs),可以克服上述SMA局限性。Oluwole等[60]发现DIBMALPs比SMALPs对二价阳离子如Mg2 耐受性更高。当Mg2 浓度超过4 mmol·L-1时,SMALPs内的蛋白质开始聚集变性,在Mg2 浓度为8~10 mmol·L-1时蛋白质全部失活。但在DIBMALPs中,当Mg2 浓度为10 mmol·L-1时,只有20%的蛋白质变性失活。Danielczak等[61]研究发现当使用DIBMA时,添加Mg2 或Ca2 可以提高提取效率。尽管DIBMA对于某些MPs的提取纯度和稳定性要比SMA低,但DIBMA对二价阳离子有更高的耐受性,可以为蛋白质构象和动力学的研究提供了更好的环境[62]。因此,选择哪种聚合物取决于所研究的目标蛋白的特征。
3.3 、聚甲基丙烯酸酯(polymethacrylate,PMA)聚合物
尽管SMA和DIBMA在一些MPs的分离纯化中取得了成功[63],但存在SMA对二价阳离子耐受性低、DIBMA提取纯度和稳定性低的缺陷并且这两种聚合物都有强烈的紫外吸收,可能干扰紫外检测[57]。因此人们开始寻找非“烯烃-马来酸支架”替代聚合物。最近,两亲性聚甲基丙烯酸酯聚合物(polymethacrylate,PMA)被证明可将脂质双分子层溶解成纳米圆盘。PMA比常见的苯乙烯-马来酸聚合物具有潜在的优势,但目前PMA对于MPs的纯化应用较少[64]。Lavington等[63]以神经紧张素受体1 (NTSR1)为对象,探索使用PMA的无洗涤剂纯化。通过使用Sf9细胞中表达的NTSR1-eGFP融合蛋白,筛选了一系列的增溶条件,证明了温度、pH、NaCl浓度以及聚合物和膜样品的相对数量的重要性。此外还发现PMA对二价阳离子有一定耐受性。PMA溶解的NTSR1比洗涤剂溶解的NTSR1表现出更大活性,这表明PMALPs为NTSR1提供了更天然的膜环境[63]。因此,PMA是一种可替代SMA的MPs纯化方法,在研究NTSR1和其他MPs方面具有良好的前景。表2比较了SMA、DIBMA、PMA的组成、优缺点及其应用。
Table 2 Comparison of different types of polymers
4 、慢病毒载体稳定技术
慢病毒(lentivirus)载体是以人类免疫缺陷I型病毒(HIV-1)为基础发展起来的基因载体。慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的基因的效果。基于慢病毒颗粒(lentivirus particles,LVPs)作为MPs载体的策略是将目的基因插入慢病毒转染所需的质粒当中,慢病毒从包装细胞出芽的过程中会携带包装细胞的细胞膜片段,从而获得细胞膜上的MPs[65]。这种慢病毒稳定策略具有以下优点:①慢病毒颗粒表面的MPs受体表达水平高,活性高;②慢病毒颗粒可以直接固定在芯片上,无需标记;③慢病毒颗粒易于表达和纯化。因此,基于慢病毒颗粒的稳定策略在研究MPs与配体之间的相互作用方面有巨大潜力,Heym等[11]将慢病毒颗粒结合表面等离子体共振(surface plasmon resonance,SPR)和表面声波技术应用于GPCR与其配体(CXCR4抗体-12G5、AMD3100)的结合动力学研究。结果显示,该方法得到的动力学参数和亲和参数,与经典的细胞亲和实验测量值一致,为靶向GPCRs的小分子动力学分析提供基础。此外,Hoffman等[66]构建LVPs-SPR体系来研究趋化因子受体4(cx-chemokine receptor 4,CXCR4)与其配体的相互作用。以293T细胞为宿主,构建了高/低表达CXCR4的慢病毒颗粒,并将其偶联在Biacore F1芯片上进行CXCR4的抗体亲和力评估。表3总结比较了上述MPs稳定技术的原理、分类以及优缺点。
Table 3 Comparison of four membrane protein stabilization techniques
5 、MPs稳定技术结合表面等离子共振技术在药物筛选中的应用
MPs配体药物筛选和MPs的生物标志物发现是目前新药研发的重要方向。据统计在DrugBank数据库中,已批准的药物靶点中有54%是MPs。截至2017年,FDA批准的分子靶标中只有667个是蛋白质,而在DrugBank数据库中的MPs靶标总数为3 041个[2,67]。可见,批准的MPs靶标数远少于MPs靶标总数。MPs的低表达量以及强疏水性等特点限制了MPs靶标的体外研究以及配体药物筛选。因此,MPs稳定技术结合表面等离子共振技术的发展给众多待开发的潜在MPs靶标和相关配体药物筛选带来了曙光。
目前针对MPs的配体高通量筛选技术中最具代表性的是SPR。它是一种敏感的表面分析技术,它是通过分子吸附在重金属膜上引起介电常数的变化来进行检测,自20世纪90年代以来,这种方法被广泛用于简单的蛋白配体以及小分子药物的高通量筛选[68]。Johzuka等[69]建立了高精度表面等离振子共振(HP-SPR)-3D系统,它能在加药1 h内对抗癌药物进行模拟体内表型筛选。Wang等[70]模拟了PD-1 / PD-L1在蛋白质-蛋白质界面上的潜在结合区域,在内部肽库中结合虚拟筛选和SPR亲和力评估,得到三种PD-1靶向肽抑制剂。此外,SPR也成功应用于表皮生长因子受体的配体[71]、泛素化抑制剂[72]、IL-6家族细胞因子受体GP130 PPI抑制剂[73]的筛选。
然而,对于GPCR、ABC转运蛋白等表达量低且结构复杂的多次跨MPs,当它们直接与固体底物特别是Biacore系统中的金底物接触时,MPs通常会失去功能或变性。所以,研究者们引入MPs稳定技术获得活性良好的MPs,再与SPR结合用于其相应的配体药物的筛选。Komolov等[74]将洗涤剂稳定化的视紫红质蛋白偶联于SPR芯片表面,成功用于分析视紫红质蛋白与其配体间的相互作用。与经典的洗涤剂策略相比,人造膜稳定策略结合SPR技术在MPs配体筛选以及新药研发中应用更为广泛。Oshima等[75]将包裹有hERG通道蛋白的人工双层脂质膜重建在硅芯片的微孔中,评价了这个体系的耐用性,随后Tadaki等[76]优化了该组装过程,Komiya等[36]根据优化后条件,将该系统定量评价西沙必利对细胞合成hERG钾通道的作用。结果发现用该体系测得的IC50与膜片钳法测量值一致,最终建立了作用于hERG钾离子通道的药物快速筛选平台。Das等[45]将纳米盘稳定技术和局域表面等离子体共振技术(LSPR)结合,用于分析12种小分子药物与细胞色素P450 3A4酶的结合类型。结果显示,溴隐亭、睾酮、洛伐他汀、阿德司琼、α-萘酚酮、红霉素和硝苯地平为I型药物,通过取代配位水分子来调节酶活性;酮康唑、伊曲康唑、曲酰环丙胺、双氯芬酸和特非那定为II型药物,通过直接与铁结合来抑制酶。Maynard等[77]为解决GPCR配体筛选方法的局限性,首先用脂质双分子层将GPCR分离纯化,随后通过纳米孔将其固定在芯片上,用SPR技术采集GPCR配体结合的剂量-反应曲线,建立了GPCR配体的高通量筛选平台。Rich等[78]以SPR技术建立了CCR5蛋白最佳的增溶条件筛选体系,以抗体Fab(2D7)为阳性药,在96种不同的洗涤剂中找出既能有效溶解受体又能保持其活性的洗涤剂,结果显示大多数保持CCR5活性的去污剂是带有C9到C13烷基尾的麦芽糖,而短(≤C8)或长(≥C14)烷基链的麦芽糖是无效的增溶剂。Xu等[79]采用纳米圆盘稳定的离子通道蛋白KcsA-Kv1偶联于SPR芯片上,用于分析KcsA-Kv1蛋白及其抑制剂间的相互作用。
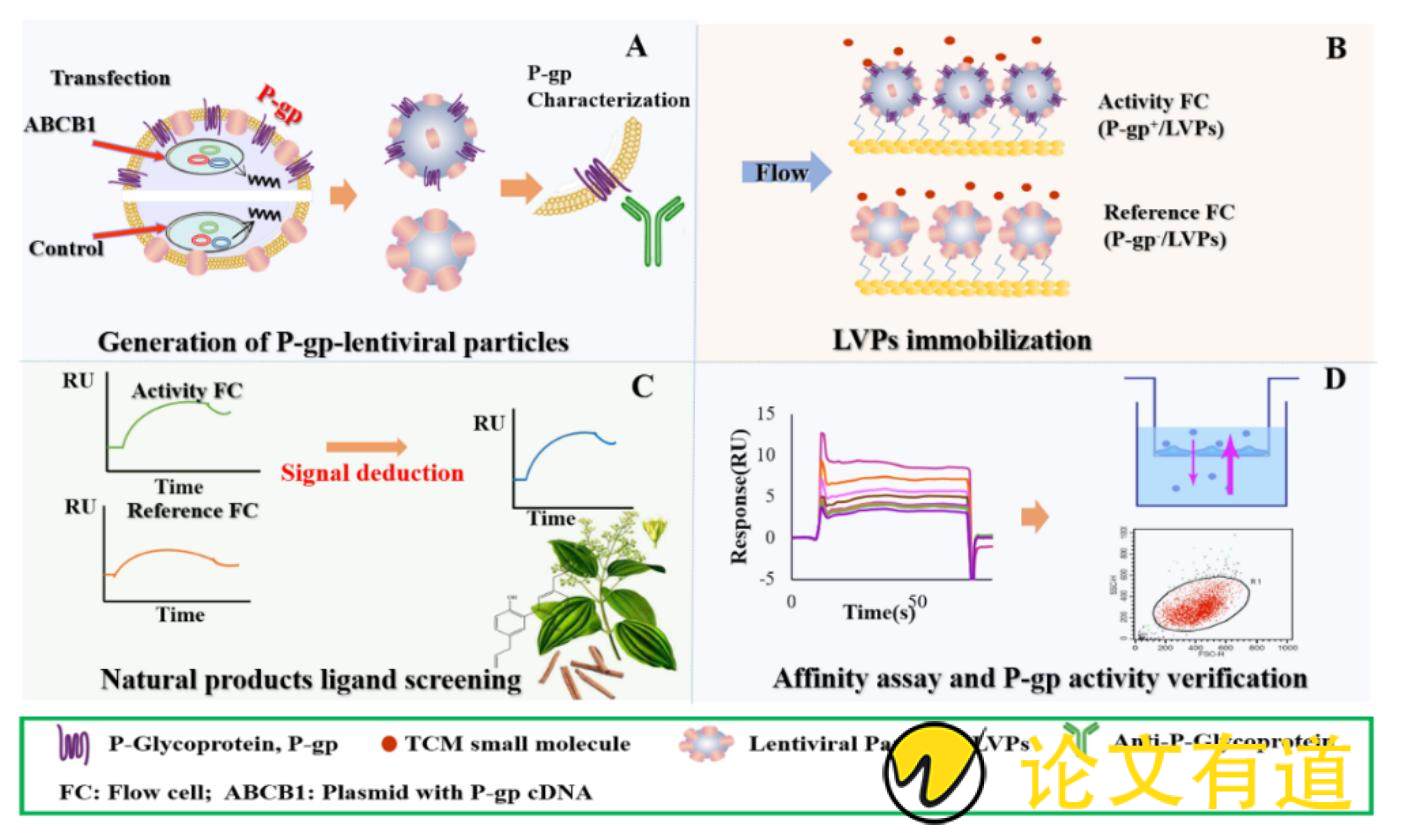
针对慢病毒载体稳定技术结合SPR在中药活性成分筛选中的应用,本课题组已展开一些探索性研究。P-糖蛋白(P-gp)是体内最重要的外排型转运蛋白,具有12次跨膜的复杂结构,且尚未商品化。Cao等[80]采用LVPs稳定策略,获得活性良好的P-糖蛋白,构建了一种基于SPR的P-糖蛋白配体筛选系统。首先,获得P-gp高表达和低表达的LVPs,然后将P-gp高/低表达的LVPs分别固定在CM5芯片上作为活性通道和参比通道。以P-gp抑制剂伐司朴达(valspodar, Val)和环孢素(cyclosporin, CsA)为阳性对照,从天然产物库中快速筛选出厚朴酚、和厚朴酚和白藜芦醇作为潜在的P-gp配体(图4)[80]。Chen等[81]构建了CXCR4的配体筛选体系,将高/低表达的CXCR4的慢病毒颗粒固定在CM5芯片上,以趋化因子受体拮抗剂AMD3100为阳性化合物,从川芎提取物中筛选出洋川芎内酯Ⅰ为CXCR4的潜在配体。
MPs稳定技术在面向结构复杂的MPs的药物筛选中是不可缺少的关键技术,它能够模拟MPs所需的天然脂质环境,保证MPs结构和功能的完整性,为建立高专属性、高灵敏度和高通量的药物筛选方法提供技术支撑。
Figure 4 Work flow of screening P-gp small molecule ligands from natural products based on SPR-PLSS. A: To prepare high and low expression P-gp-LVPs; B: To fix different expression P-gp-LVPs on different channels of the chip; C: To obtain the affinity between natural products and P-gp through dual channel signal derivation, and to screen target compounds with significant response signal; D: To verify the effect of active compounds on the function and expression of P-gp [80]
6 、小结与展望
MPs功能的完整性对于药物靶点的发现和新药研发至关重要,而MPs的稳定技术是保障其基本功能完整性的关键。本文总结了近年来MPs稳定技术的发展。最初研究人员利用洗涤剂胶束来分离MPs,但此方法忽略了天然脂质环境对MPs结构和功能的独特作用;人造膜稳定技术有助于模拟MPs天然的功能和结构,但在人造膜组装过程中仍然需要应用洗涤剂增溶,未能避免洗涤剂应用中产生的问题;目前最新的聚合物稳定技术在完全无洗涤剂的环境下可以将目的蛋白与天然脂质双分子层一起分离,使其保持天然的膜环境,能在最大程度上减少MPs结构和功能的缺失;而慢病毒颗粒稳定策略无需处理就能直接与SPR芯片结合,使得其在下游应用特别是与SPR联用上有其独特优势。然而上述这些策略仍然存在一些技术难点,包括如何增加MPs提取的特异性,如何减少MPs提取过程中带来的结构和功能的缺失,需要更全面的MPs功能验证来确保所建立的方法的准确性。因此,研究人员一直致力于开发新型MPs稳定技术,以期在维持MPs正确结构的前提下获得纯度较高的目标MPs。尽管MPs稳定技术在药物筛选中已联合SPR技术有了一些应用,但今后仍需拓宽其应用范围,以更好地服务于药物靶标发现与配体筛选。MPs的稳定是药物研究中亟待解决的科学问题,开发特异性强、效率更高的新型MPs稳定技术任重而道远。
参考文献
[1] Lappano R, Maggiolini M. G protein-coupled receptors: novel targets for drug discovery in cancer[J]. Nat Rev Drug Discov, 2011, 10: 47-60.
[2] Santos R, Ursu O, Gaulton A, et al. A comprehensive map of molecular drug targets[J]. Nat Rev Drug Discov, 2017,16: 19-34.
[3] Wu CP, Ambudkar VS. The pharmacological impact of ATP-binding cassette drug transporters on vemurafenib-based therapy[J]. Acta Pharm Sin B, 2014, 4: 105-111.
[4] Minuesa G, Huber-Ruano 1, Pastor-Anglada M, et al. Drug uptake transporters in antiretroviral therapy[J]. Pharmacol Ther, 2011, 132: 268-279.
[5] Hauser AS, Attwood MM, Rask-Andersen M, et al. Trends in GPCR drug discovery: new agents, targets and indications[J]. Nat Rev Drug Discov, 2017, 16: 829-842.
[6] Yang C, He B, Dai W, et al. The role of caveolin-1 in the biofate and efficacy of anti-tumor drugs and their nano-drug delivery systems[J]. Acta Pharm SinB, 2021, 11: 961-977.
[7]He Y, Wang K, Yan N. The recombinant expression systems for structure determination of eukaryotic membrane proteins[J]. Protein Cell, 2014, 5: 658-672.
[8] Das M, Du Y, Mortensen JS, et al. Correction: trehalose-cored amphiphiles for membrane protein stabilization: importance of the detergent micelle size in GPCR stability[J]. Org Biomol Chem, 2019, 17: 4919-4920.
[9] Fiori MC, Jiang Y, Zheng W, et al. Polymer nanodiscs: discoidal amphiphilic block copolymer membranes as a new platform for membrane proteins[J]. Sci Rep, 2017, 7: 15227-15236.
[10] Bada Juarez JF, Harper AJ, Judge PJ, et al. From polymer chemistry to structural biology: the development of SMA and related amphipathic polymers for membrane protein extraction and solubilisation [J] Chem Phys Lipids, 2019, 221: 167-175.
[11] Heym RG, Hornberger WB, Lakics V, et al. Label-free detection of smal-molecule binding to a GPCR in the membrane environment [J]. Biochim Biophys Acta, 2015, 1854: 979-986.
[12] Anandan A, Vrielink A. Detergents in membrane protein purification and crystallisation[J]. Adv Exp Med Biol, 2016, 922: 13-28.
[13] Lichtenberg D, Ahyayauch H, Alonso A, et al. Detergent solubilization of lipid bilayers: a balance of driving forces[J]. Trends Biochem Sci, 2013, 38: 85-
[14] Kotov V, Bartels K, Veith K, et al. High-throughput stability screening for detergent-solubilized membrane proteins[J]. Sci Rep, 2019, 9: 10379-10398.
[15] Iwata S. Methods and Results in Crytallization of Membrane Proteins [M]. La Jolla : International Unversity Line Press, 2003: 106-114.
[16] Newstead S, Kim H, Von Heijne G, et al. High-throughput fluorescent-based optimization of eukaryotic membrane protein overexpression and purification in Saccharomyces cerevisiae[J]. Proc Natl Acad SciU S A, 2007, 104: 13936- 13941.
[17] Newstead S, Ferrandon S, Iwata S. Rationalizing alpha-helical membrane protein crystallization[J]. Protein Sci, 2008, 17: 466-472.
[18] Hiller S, Garces RG, Malia TJ, et al. Solution structure of the integral human membrane protein VDAC-1 in detergent micelles[J]. Science, 2008, 321: 1206-1210.
[19] Metola A, Bouchet AM, Alonso-Mario M, et al. Purification and characterization of the colicin A immunity protein in detergent micelles[J]. Biochim Biophys Acta Biomembr, 2017, 1859: 2181-2192.
[20] Mcgregor CL, Chen L, Pomroy NC, et al. Lipopeptide detergents designed for the structural study of membrane proteins[J]. Nat Biotechnol, 2003, 21: 171-176.
[21] Das M, Mahler F, Hariharan P, et al. Diastereomeric cyclopentane-based maltosides (CPMs) as tools for membrane protein study[J]. J Am Chem Soc, 2020, 142: 21382-21392.
[22] Hardy D, Bill RM, Rothnie AJ, et al. Stabilization of human multidrug resistance protein 4 (MRP4/ABCC4) using novel solubilization agents[J]. SLAS Discov, 2019, 24: 1009-1017.
[23] Hyoung EB, Du Y, Hariharan P, et al. Asymmetric maltose neopentyl glycol amphiphiles for a membrane protein study: effect of detergent asymmetricityon protein stability[J]. Chem Sci, 2019, 10: 1107-1116.
[24] Hussain H, Du Y, Tikhonova E, et al. Resorcinarene based facial glycosides: implication of detergent flexibility on membrane -protein stabiity[J]. Chemistry, 2017, 23: 6724-6729.
[25] Ensan M, DU Y, Mortensen JS, et al. Selt-assembly Denavior and appication of terpnenyl-cored trmaltosides tor membrane-protein studies: impact of detergent hydrophobic group geometry on protein stability[J]. Chem Eur J, 2019, 25: 11545-11554.
[26] Sadaf A, Ramos M, Mortensen JS, et al. Conformationally restricted monosaccharide cored glycoside amphiphiles: the effect of detergent headgroup Variation on membrane protein stability[J]. ACS Chem Biol, 2019, 14: 1717-1726.
[27] Hussain H, Helton T, Du Y, et al. A comparative study of branched and linear mannitol-based amphiphiles on membrane protein stability[J]. Analyst, 2018, 143: 5702-5710.
[28] Rothnie AJ. Detergent-free membrane protein purification[J]. Methods Mol Biol, 2016, 1432: 261-267.
[29] Reeves JP. Formation and properties of thin-walled phospholipid vesicles[J]. J Cell Physiol, 1969, 73: 49-60.
[30] Traikia M, Warschawski DE, Recouvreur M, et al. Formation of unilamellar vesicles by repetitive freeze-thaw cycles: characterization by electron microscopy and 31P-nuclear magnetic resonance[J]. Eur Biophys J 2000, 29: 184-195.
[31] Pott T, Bouvrais H, Meleard P. Giant unilamellar vesicle formation under physiologically relevant conditions[J]. Chem Phys Lipids, 2008, 154: 115-119.
[32] Johnson ZL, Lee SY. Liposome reconstitution and transport assay for recombinant transporters[J]. Methods Enzymol, 2015, 556: 373-383.
[33] Hunte C, Richers S. Lipids and membrane protein structures[J]. Curr Opin Struct Biol, 2008, 18: 406-411.
[34] Kurisu G, Zhang H, Smith JL, et al. Structure of the cytochrome b6f complex of oxygenic photosynthesis. tuning the cavity[J]. Science, 2003, 302: 1009-1014.
[35] Jidenko M, Nielsen R, Sorensen T, et al. Crystallization of a mammalian membrane protein overexpressed in Saccharomyces cerevisiae[J]. Proc Natl Acad SciU S A, 2005, 102: 11687-11691.
[36] Komiya M, Kato M, Tadaki D, et al. Advances in artificial cell membrane systems as a platform for reconstituting ion channels[J]. Chem Rec, 2020 Jul,20: 730-742.
[37] Sanders CR, Prosser RS. Bicelles: a model membrane system for all seasons?[J]. Structure, 1998, 6. 1227-1234.
[38] Leitz AJ, Bayburt TH, Barnakov AN, et al. Functional reconstitution of Beta2- adrenergic receptors uilizing self-assembling nanodisc technology[J]. BioTechniques, 2006, 40: 601-602.
[39] Nath A, Atkins WM, Sligar SG. Applications of phospholipid bilayer nanodiscs in the study of membranes and membrane proteins [J]. Biochemistry, 2007, 46: 2059-2069.

