
Abstract:Objective: To establish a method for microbial limit test on ephedrine and furacillin nasal drops for infants. Methods: By reference to Chinese Pharmacopoeia ( 2015 Edition) , the 1 ∶ 10 test solution was prepared, and the sample pretreatment was carried out under membrane-filter procedure, the applicability experiments of microbial count test and control bacteria test were conducted respectively. Results: The membrane-filter procedure could effectively eliminate the antibacterial active of ephedrine and furacillin nasal drops. The recovery ratios of the five experimental bacteria examined by microbial count were within 0. 5 ~ 2. 0. And seudomonas aeruginosa, staphylococcus aureus and escherichia coli can be detected in control bacteria. Conclusion: With the inspection method and test conditions of 1 ∶ 10 dilution method and membrane-filter procedure, the applicability experiments has confirmed that microbial limit test of ephedrine and furacillin nasal drops for infants can be performed.
Keyword:ephedrine and furacillin nasal drops for infants; microbial limit test; microbial count test; controlled bacteria test; membrane-filter procedure;
小儿呋麻滴鼻液在我院临床应用多年, 为儿科和耳鼻喉科常用的医院制剂, 其主要成分是盐酸麻黄碱和呋喃西林, 辅料有氯化钠和羟苯乙酯等, 性状呈淡黄色澄明液体, 味苦, 微咸, 有消炎和收缩血管作用, 用于鼻炎、鼻黏膜肿胀等疾病的治疗[1]。该制剂由本院制剂室生产, 年产量约1.4万支, 质量控制检查包括鉴别、装量、含量测定和微生物检查等[2]。随着我国药品质量逐步实施国际最高技术标准, 2015年版《中华人民共和国药典》接轨国际标准, 在微生物检查方面有重大改变[3]。现有制剂的微生物检查方法, 应进行更新, 但此类研究报道较少。本研究拟建立小儿呋麻滴鼻液的微生物检查法并进行方法适用性研究, 希望为药品质量控制部门提供参考。

1、实验材料
1.1、仪器
HTY-APL01集菌仪、薄膜过滤器、KSF330集菌培养器 (杭州泰林生物技术设备有限公司) ;PYX-DHS电热恒温培养箱 (上海跃进医疗器械一厂) ;MJ-250I霉菌培养箱 (上海一恒科技有限公司) ;Microflex LT质谱仪 (德国布鲁克道尔顿公司) ;CLG-32L高压蒸汽灭菌锅 (日本ALPCO, Ltd公司) ;M017生物安全柜 (Thermo Fisher Scientific) ;SW-CJ医用型洁净工作台 (苏州安泰空气技术有限公司) 。
1.2、试剂
小儿呋麻滴鼻液 (医院制剂室自制, 每支5 m L, 批号161219、170410、170509) 。胰酪大豆胨琼脂培养基 (TSA, 批号161104) , 沙氏葡萄糖琼脂培养基 (SDA, 批号161227) , 胰酪大豆胨液体培养基 (TSB, 批号170114) , 溴化十六烷基三甲铵琼脂培养基 (批号160218) , 甘露醇氯化钠琼脂培养基 (批号160607) , 麦康凯液体培养基 (Mac B, 批号160902) , 麦康凯琼脂培养基 (Mac A, 批号160926) 。培养基配制后121℃高压蒸汽灭菌。培养基产自上海中科昆虫生物技术开发有限公司。稀释液和冲洗液为0.9%无菌氯化钠溶液 (上海交通大学医学院附属新华医院制剂室自制) 。
1.3 实验菌种
大肠埃希菌[CMCC (B) 44102]、铜绿假单胞菌[CMCC (B) 10104]、金黄色葡萄球菌[CMCC (B) 26003]、枯草芽孢杆菌[CMCC (B) 63501]、白色念珠菌[CMCC (F) 98001]和黑曲霉[CMCC (F) 98003]。实验菌种为中国食品药品检定研究院提供的0代菌种, 实验前传代至第4代。
2、方法
2.1、实验菌液的制备
参照2015版《中华人民共和国药典》方法, 制备第4代各菌种的菌液[3]。稀释液为无菌的0.9%氯化钠溶液, 最终菌液浓度为每毫升含菌50~100 cfu。菌液室温放置在2 h内即用, 若放置在2~8℃冰箱, 可在24 h内使用。
2.2、1∶10供试液制备和样品前处理
取小儿呋麻滴鼻液样品2支, 每支量取5 m L, 共10m L加入无菌具塞锥形瓶, 用无菌的0.9%氯化钠溶液稀释至100 m L, 混匀, 制备成1∶10的供试液, 制备后1 h内完成接种。
2.3、微生物计数检查方法的适用性实验
计数检查分为需氧菌、霉菌和酵母菌的总数检查。每个菌种的验证实验分别分为以下4组。加菌实验组:取1∶10供试液10 m L, 经薄膜过滤器过滤, 无菌的0.9%氯化钠溶液冲洗3次, 每次100 m L, 在最后一次的冲洗液中加入50~100 cfu的实验菌。供试品对照组:操作同加菌实验组, 最后一次冲洗液不加菌。菌液对照组:用无菌的0.9%氯化钠溶液替代供试液, 操作同加菌实验组, 最后一次冲洗液加入50~100 cfu的实验菌。稀释液对照组:用无菌的0.9%氯化钠溶液替代供试液, 操作同加菌实验组, 最后一次冲洗液中不加菌。
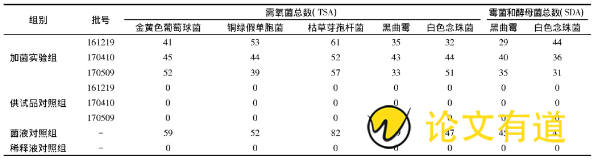
将各菌种的4组滤膜分别取出, 菌面朝上贴于TSA或SDA培养基平板上, 根据培养基的不同和菌种的不同选择相应的培养条件进行培养。需氧菌总数检查:金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌接种于TSA平板, 33℃培养不超过3 d;白色念珠菌和黑曲霉接种于TSA平板, 33℃培养不超过5 d。霉菌和酵母菌总数检查:SDA平板接种白色念珠菌和黑曲霉, 23℃培养不超过5 d。3个批号的菌种分别进行独立平行实验, 每个菌种平行操作2个平皿, 取2个平皿的平均菌落数作为计数结果。
实验菌的计数检查回收比= (加菌实验组菌落数-供试品对照组菌落数) /对照组菌落数。该比值若在0.5~2.0范围内, 认为该检查方法和实验条件适合于小儿呋麻滴鼻液的微生物限度检查。
2.4、微生物控制菌检查的方法适用性实验
小儿呋麻滴鼻液作为鼻用制剂, 控制菌不得检出铜绿假单胞菌、金黄色葡萄球菌和大肠埃希菌[3]。使用KSF330三联集菌培养器分3组进行薄膜过滤法, 3种菌液分别进行适用性实验。加菌实验组:取1∶10供试液10 m L, 集菌器过滤, 0.9%无菌氯化钠溶液冲洗3次, 每次100 m L, 最后一次冲洗液中加入50~100 cfu实验菌, 集菌器泵入100 m L TSB培养基。供试品对照组:最后一次冲洗液不加菌, 其余同加菌实验组。稀释液对照组:用无菌的0.9%氯化钠溶液替代供试液, 最后一次冲洗液不加菌, 其余同加菌实验组。泵入TSB培养基的三联集菌器在33℃培养18~24 h, 进行以下操作。
铜绿假单胞菌检查:取TSB培养物划线接种于溴化十六烷基三甲铵琼脂培养基平板上, 33℃培养18~72 h。金黄色葡萄球菌检查:取TSB培养物划线接种于甘露醇氯化钠琼脂培养基平板上, 33℃培养18~72 h。大肠埃希菌检查:取TSB培养物1 m L, 接种至100 m L Mac B培养基中, 42℃培养24~48 h, 取Mac B培养物划线接种于Mac A平板上, 33℃培养18~72 h。
上述三种平板若有菌落生长, 使用Microflex LT质谱仪进行分离纯化鉴定, 判断是否检出控制菌。若经质谱仪鉴定, 加菌实验组检出控制菌, 供试品对照组和稀释液对照组均未检出, 可以确认小儿呋麻滴鼻液的控制菌检查方法适用[3]。
3、结果
3.1、需氧菌总数、霉菌和酵母菌总数计数检查的方法适用性检查结果
3个批次样品的微生物计数培养结果见表1, 回收率比值见表2。3个批次的独立平行实验, 所有实验菌种的回收比值均在0.5~2.0的范围, 认为本检查方法和检验条件, 能够消除抑菌成分的影响, 适用于小儿呋麻滴鼻液的微生物计数检查。
表1 小儿呋麻滴鼻液微生物计数方法的适用性实验结果
3.2、控制菌检查的方法验证结果
3个批次的小儿呋麻滴鼻液的加菌实验组均有菌落生长, 经过Microflex LT质谱仪鉴定确认为大肠埃希菌、铜绿假单胞菌和金黄色葡萄球菌。供试品对照组和稀释液对照组均未见菌落生长。因此, 本文采用1∶10稀释和薄膜过滤的检查方法和培养条件, 适用于小儿呋麻滴鼻液的微生物限度检查。见表3。
表2 小儿呋麻滴鼻液微生物计数方法的适用性实验回收比值
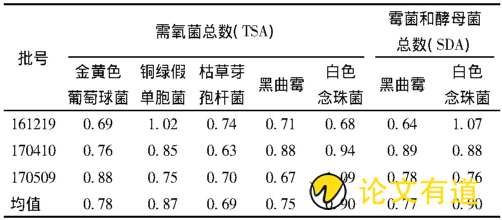
表3 小儿呋麻滴鼻液控制菌检查方法验证结果

4、讨论
4.1、药品微生物检查的进展
近20年以来, 《中国药典》的每次新版出台都对药品微生物检查的要求有大的更新[4]。2017年6月, 中国国家食品药品监督管理总局以成员身份加入国际人用药品注册技术协调会 (ICH) [5]。这意味着我国药品监管部门、制药行业和研发机构将逐步实施国际最高技术标准和指南。2015版《中国药典》关于微生物检查的重大变化, 接轨了ICH以及美国、欧盟和日本药典的要求, 旨在提升国内制药产业的国际竞争力。医院制剂应严格遵循药典要求, 对微生物检查方法及时更新并验证, 以更好地为患者服务, 获得良好的生存与发展机会[6]。
4.2、实验菌种和培养基的选择
根据2015版《中国药典》要求, 需氧菌计数检查的验证菌种用铜绿假单胞菌替代了2010版的大肠埃希菌, 菌落形态更为稳定, 更适合方法验证性研究[7]。需氧菌总数检查采用TSA培养基替代了营养琼脂培养基;霉菌和酵母菌总数检查采用SDA培养基替代了玫瑰红钠琼脂培养基, 适合样品中微生物复苏生长, 提高了检测灵敏度[7]。控制菌检查选用TSB培养基替代营养肉汤进行预增菌, 对受伤菌种有复壮培养作用, 可以提高检出率[8]。
4.3、样品的预处理
小儿呋麻滴鼻液中呋喃西林含量0.02%, 辅料羟苯乙酯含量为0.03%, 这两个组分对微生物检查均有较大影响, 常规稀释法和培养基稀释法不能完全去除干扰, 因此首选薄膜过滤法消除抗菌活性[9,10]。控制菌检查使用了一次性集菌器, 操作简便但耗材成本略高。如考虑经济学因素, 这一步骤可以用多次薄膜过滤器取代, 或在下一步研究中进行耗材费用的比对。本研究稀释液和冲洗液采用了2015版《中国药典》许可的0.9%氯化钠灭菌溶液, 与2010版药典建议的蛋白胨溶液比较, 获取便利、成本降低。
综上所述, 经过方法适用性实验确认, 小儿呋麻滴鼻液经过供试液稀释和薄膜过滤法, 有效消除了呋喃西林和羟苯乙酯的抗菌活性, 可用作微生物限度检查的常规方法。
参考文献
[1]小儿呋麻滴鼻液成品质量标准[S].批准文号:沪药制字Z04180745.执行标准SYZ-ZF-017-2004.
[2]朱鹏程, 吴敏, 唐跃年, 等.小儿呋麻滴鼻液的定性及定量质量控制标准研究[J].中国医药导报, 2016, 13 (12) :520-527.
[3]国家药典委员会.中华人民共和国药典 (四部) [S]. 2015年版.北京:中国医药科技出版社, 2015:136-151.
[4]胡昌勤.药品微生物控制现状与展望[J].中国药学杂志, 2015, 50 (20) :1747-1751.
[5]我国正式加入国际药品监管体系[J].中华医学信息导报, 2017, 32 (12) :6.
[6]龙荣, 彭芳玲, 胡勤, 等.在实践中体会医院制剂的生存与发展[J].儿科药学杂志, 2007, 13 (5) :36-37.
[7]杨晓莉, 李辉, 马英英, 等.中国药典2015年版非无菌产品微生物限度检查微生物计数法解读[J].药物分析杂志, 2016, 36 (6) 1101-1107.
[8]杨晓莉, 李辉, 马英英, 等.《中国药典》2015年版非无菌产品微生物限度检查:控制菌检查法解读与对策[J].中国药师, 2016, 19 (4) :748-752.
[9]李俨, 姜丽.呋喃西林片2015年版微生物限度检查标准及探索性研究[J].中国卫生标准管理, 2016, 7 (15) :121-123.
[10]杜建红, 袁涛, 张国庆, 等.羟苯乙酯醇溶液微生物限度检查方法验证[J].中国药房, 2014, 25 (37) :3513-3515.

